Какой химический элемент галоген фосфор йод сера ксенон
Обновлено: 04.07.2024
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF - фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl - хлороводород (газ), соляная кислота (жидкость)
- HBr - бромоводород, бромоводородная кислота
- HI - йодоводород, йодоводородная кислота
- HAt - астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI - газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H 2 + Cl 2 → 2HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H 2 SO 4 → NaHSO 4 + HCl↑
CaF 2 + H 2 SO 4 → CaSO 4 + 2HF
PBr 3 + 3H 2 O → 3HBr↑ + H 3 PO 3
H 2 S + I 2 → S + 2HI
Химические свойства
HF - является слабой кислотой, HCl, HBr, HI - сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Mg + 2HBr → MgBr 2 + H 2 ↑
Zn + 2HCl → ZnCl 2 + H 2 ↑
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na 2 O + 2HCl → 2NaCl + H 2 O
ZnO + 2HI → ZnI 2 + H 2 O
KOH + HCl → KCl + H 2 O (реакция нейтрализации)
Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO 3 + HCl → AgCl + HNO 3
Li 2 CO 3 + 2HBr →2 LiBr + H 2 CO 3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
4HI + MnO 2 → I 2 + MnI 2 + 2H 2 O
2HI + H 2 SO 4 → I 2 + H 2 S + H 2 O
4HI + O 2 → 2H 2 O +2 I 2
2HI + Br 2 → 2HBr + I 2
2HCl + H 2 SO 4 → Cl 2 + SO 2 + 2H 2 O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO 2 с плавиковой кислотой.
SiO 2 + 4HF → SiF 4 + 2H 2 O
Растворение стекла в плавиковой кислоте.mp4
Галогениды - соли галогеноводородов
Обнаружить ионы галогенов возможно воздействием на растворы солей, содержащих галоген ион нитратом серебра (AgNO3). При наличии хлор-иона образуется белый творожистый осадок хлорида серебра: NaCl + AgNO3 → NaNO3 + AgCl↓ При наличии бром-иона образуется бледно-желтый творожистый осадок бромида серебра: NaBr + AgNO3 → NaNO3 + AgBr↓ При наличии бром-иона образуется желтый творожистый осадок иодида серебра: NaJ + AgNO3 → NaNO3 + AgJ↓
Осадки не растворимы в воде и азотной кислоте.
Качественные реакции на хлорид , бромид и йодид ионы.mp4
Применение галогенов и их соединений
Природное соединение фтора — криолит Na3AlF6 — применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон. Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Токсичность галогенов
Вследствие высокой реакционной способности (особенно это ярко проявляется у фтора) все галогены являются ядовитыми веществами с сильно выраженным удушающим и поражающим ткани воздействиями.Большую опасность представляют пары и аэрозоль фтора, так как в отличие от других галогенов имеют довольно слабый запах и ощущаются только в больших концентрациях.
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Сравнительная характеристика галогенов
I. Нахождение галогенов в природе
Галогены в природе находятся только в виде соединений.
Фтор встречается исключительно в виде солей, рассеянных по различным горным породам. Общее содержание фтора в земной коре составляет 0,02% атомов. Практическое значение имеют минералы фтора: CaF2 - плавиковый шпат (рис.1), Na2AlF6 - криолит (рис.2), Ca5F(PO4)3 - фторапатит (рис.3).



Рис.1. Плавиковый шпат Рис.2. Криолит Рис.3. Фторапатит
Важнейшим природным соединением хлора является хлорид натрия (галит), который служит основным сырьем для получения других соединений хлора. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl – таковы, например озера Эльтон и Баскунчак. Встречаются другие соединения хлора, например, KСl - сильвин, MgCl2*KCl*6HO - карналлит, KCl*NaCl - сильвинит.
Бром встречается в природе в виде солей натрия и калия вместе с солями хлора, а также в воде соленых озер и морей. Бромиды металлов содержатся в морской воде. В подземных буровых водах, имеющих промышленное значение, содержание брома составляет от 170 до700мг/л. Общее содержание брома в земной коре 3*10-5% атомов.
Соединения йода имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно. Однако существуют некоторые водоросли, которые накапливают йод в своих тканях, например ламинарии. Зола этих водорослей служит сырьем для получения йода. Значительное количество йода( от 10 до 50мг/л.) содержатся в подземных буровых водах. Содержание йода в земной коре 4*10-6 % атомов. Существуют незначительные залежи солей йода - KIO3 и KIO4 - В Чили и Боливии.
Общая масса астата на земном шаре по оценкам не превышает 30 г.
Таблица. Электронное строение и некоторые свойства атомов и молекул галогенов
Одна из дорог, ведущих в Рим к местам соледобычи, так и называлась – Via Salaria (Соляная дорога). Это древнее название сохранилось и по сей день. Почему же обычной поваренной соли, знакомой каждому с детства, воздают такие почести?

В древности соль добывали из соляных озёр, расположенных неподалеку от устья реки Тибр. Позже ее стали получать из морской воды. Для этого участки суши, затопляемые во время прилива, специально огораживали. По мере испарения воды первой кристаллизовалась поваренная соль. Ее собирали, а остававшийся рассол, содержащий прочие соли, выливали обратно в море.
Соляную кислоту HCl в Средние века называли соляным спиртом. Впервые она упоминается в сочинениях немецкого алхимика Василия Валентина во второй половине XV в. Им описан метод получения соляного спирта сухой перегонкой смеси, состоящей из купороса, квасцов и поваренной соли. Алхимики изучали действие соляного спирта на металлы и оксиды. А вот состав этого вещества долгое время был для учёных загадкой.
Как открывали галогены

Заветной мечтой многих поколений химиков было выделить фтор в свободном виде. Одним из первых такую попытку предпринял Дэви, однако проведенный им электролиз плавиковой кислоты не принёс результатов. Скорая смерть помешала учёному продолжить начатые исследования. Химики, посвятившие себя вслед за Дэви проблеме выделения свободного фтора, получили серьёзные отравления, так и не достигнув желаемого, ведь многие из них не представляли, насколько сильным окислителем является этот газ. Профессор Политехнической школы в Париже Эдмонд Фреми даже наблюдал в 1854 – 1856 гг., как образуются отдельные пузырьки фтора при электролизе расплавленного флюорита, но не сумел его собрать. Впервые это удалось в 1886 г. французскому химику Анри Муассану, который в 1887 г. выделил жидкий фтор. Незадолго до смерти Муассану присудили Нобелевскую премию за получение химически чистого фтора.
Бром открыт в 1826 г. французским химиком А.Ж. Баларом. Это была его первая самостоятельная работа, и так случилось, что она увенчалась выдающимся результатом – обнаружением нового химического элемента. Пропуская хлор через соляной рассол, полученный при упаривании морской воды, Балар заметил, что раствор окрашивается в бурый цвет. Современный химик без труда объяснит это явление: хлор вытесняет бром из бромидов, содержащихся в морской воде: 2KBr + Cl2 = 2KCl + Br2.

Позднее бром стали получать кипячением подкисленного рассола с пиролюзитом MnO2:
Общие физические и химические свойства галогенов
Молекулы простых веществ-галогенов при обычных условиях имеют состав Г2, т.е. F2, Cl2, Br2, I2. Все галогены имеют характерный запах, ядовиты.
Сверху вниз в подгруппе с ростом порядкового номера закономерно изменяются физические свойства простых веществ-галогенов: температура кипения и плавления, агрегатное состояние.
Фтор – газ светло – зеленого цвета; хлор – легко сжижающийся газ желто-зеленого цвета; бром – тяжелая жидкость красно-бурого цвета; йод – твердое кристаллическое вещество с металлическим блеском. Растворимость простых веществ-галогенов в воде в подгруппе сверху вниз уменьшается. Фтор активно взаимодействует с водой, хлор – сравнительно мало растворим в воде, еще менее растворимы в воде бром и йод.
Так как у атомов галогенов на внешнем электронном слое имеется один неспаренный электрон, для них характерна валентность I.
Кроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, а поэтому соответственно числу неспаренных электронов атомы галогенов в соединениях могут проявлять валентность III, V, VII.
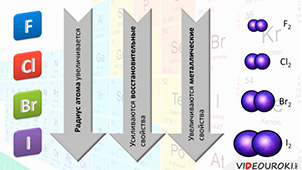
Окислительная способность атомов и молекул галогенов сверху вниз в подгруппе уменьшается от фтора к йоду, так как с увеличением радиуса атома способность галогена присоединять электроны уменьшается, т.е. уменьшаются неметаллические свойства галогенов. Фтор – самый сильный окислитель, так как атом фтора имеет наименьший радиус по сравнению с атомами других галогенов.
Окислительную активность галогенов несложно сопоставить, изучив реакции вытеснения одних галогенов другими из водных растворов галогенидов. Наблюдается такая закономерность: галоген с меньшим порядковым номером вытесняет из солей галоген с большим порядковым номером. Например, бром вытесняет йод из йодидов: Br2 + 2KI = I2 + 2KBr, но не реагирует с хлорид-ионами.
Ионы галогенов (кроме F — ) способны отдавать электроны, поэтому они являются восстановителями. Восстановительная способность галогенид-ионов увеличивается от хлорид-иона к йодид-иону: Cl — →Br — → I — .
Все галогены легко взаимодействуют с водородом по уравнению: Г2 + Н2 = 2НГ
Галогеноводороды (HF – фтороводород, HCl – хлороводород, HBr – бромоводород, HI – йодоводород) – это газообразные соединения, легко растворяются в воде. Водные растворы галогеноводородов являются кислотами: HF – фтороводородная (плавиковая), HCl – хлороводородная (соляная), HBr – бромоводородная, HI – йодоводородная.
В ряду кислот HF→ HCl→ HBr→ HI происходит усиление кислотных свойств. Это можно объяснить тем, что сверху вниз в подгруппе галогенов с увеличением заряда ядра атома увеличиваются радиусы атомов. Из всех бескислородных кислот йодоводородная кислота является самой сильной.

В ряду кислородсодержащих кислот HClO→ HClO2→ HClO3→ HClO4 наблюдается усиление кислотных свойств.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Галогены"
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.

Так как это элементы VII A группы, значит на внешнем энэргетическом уровне у них семь электронов. До завершения уровня им не хватает одного электрона, поэтому они берут этот недостающий электрон у атомов металлов, при этом образуется ионное соединение – соль, где степень окисления галогена -1.

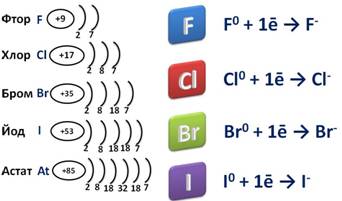
Галогены – сильные окислители, самый сильный из них фтор, который может быть только окислителем и проявлять степень окисления -1.


В группе сверху вниз – от фтора к йоду – радиус атома увеличивается, поэтому усиливаются восстановительные и металлические свойства.
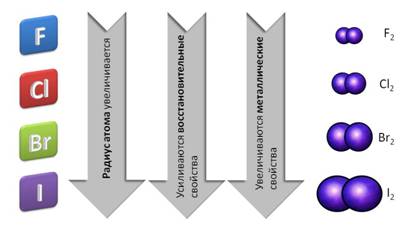
Все галогены представляют собой двухатомные молекулы, связь между атомами – ковалентная полярная. Все галогены имеют молекулярную кристаллическую решётку.
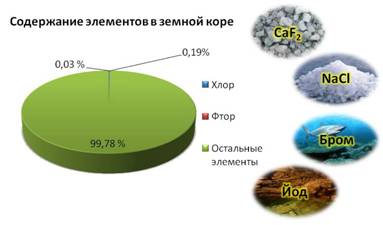
Галогены в природе существуют только в виде соединений с другими элементами. Наиболее распространены хлор и фтор, их содержание составляет 0,19% и 0,03% от массы земной коры.
Например, фтор входит в соcтав плавикового шпата, хлор входит в состав каменной соли, бром содержится в морской воде, а йод в подземных буровых водах.
Рассмотрим таблицу, в которой отражены физические свойства галогенов. Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.




Агрегатное состояние при н.у.
Температура
плавления, 0 С
Температура кипения, 0 С
Чёрно-серый (пары фиолетовые)
Из таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность. Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия. От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.

Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются. Так, в реакции цинка с фтором образуется фторид цинка. Цинк повышает свою степень окисления с 0 до +2, а фтор, наоборот, понижает степень окисления с 0 до -1. Атом цинка отдаёт по два электрона молекуле фтора. Цинк является восстановителем, а фтор – окислителем.

Остальные галогены реагируют с металлами в основном только при нагревании. Нагретый порошок железа загорается при взаимодействии с хлором. В результате этого взаимодействия образуется хлорид железа три. Железо повышает свою степень окисления с 0 до +3, а хлор понижает свою степень окисления с 0 до -1. При этом каждый атом железа отдаёт по 3 электрона молекуле хлора. Железо окисляется и является восстановителем, а хлор восстанавливается и является окислителем.

Медная проволока также сгорает в парах брома. При этом образуется бромид меди два. Медь повышает свою степень окисления с 0 до +2, а бром понижает свою степень окисления с 0 до -1. Каждый атом меди отдаёт по 2 электрона молекуле брома. Медь – восстановитель, а бром – окислитель.

Йод реагирует с алюминием, катализатором в этой реакции является вода. Алюминий повышает свою степень окисления с 0 до +3, а йод понижает свою степень окисления с 0 до -1. Каждый атом алюминия отдаёт по 3 электрона молекуле йода. Алюминий является восстановителем, а йод – окислителем. В результате этого взаимодействия образуется йодид алюминия.

Галогены также вытесняют друг друга из солей. Так, более активный галоген вытесняет из раствора соли менее активный.
Например, хлор вытесняет бром из раствора его соли, потому что хлор более активный галоген, чем бром. Хлор в данной реакции понижает свою степень окисления с 0 до -1, а бром повышает с -1 до 0. В результате чего, каждый бром отдаёт по 2 электрона молекуле хлора. Образуется новая соль – хлорид натрия и молекулярный бром. Хлор является окислителем, а бром – восстановителем.

Бром вытесняет йод из раствора йодида калия. В этой реакции бром понижает свою степень оксиления с 0 до -1, а йод повышает свою степень окисления с -1 до 0. При этом 2 электрона от йода переходят к молекуле брома. В результате взаимодействия образуется соль – бромид калия и простое вещество – йод. Бром является окислителем, а йод – восстановителем.

Для фтора эта реакция не характерна, потому что он взаимодействует с водой, а эти реакции протекают в растворе.

Галогены реагируют с водородом с образованием галогеноводородов. Например, с фтором водород реагирует со взрывом, с хлором – в присутствии света, а с бромом – при нагревании. В результате взаимодействия водорода с фтором образуется фтороводород, в результате взаимодействия водорода с хлором – хлороводород, в результате взаимодействия водорода с бромом – бромоводород.



Хлор открыт шведским химиком Шееле в 1774 году. Элемент получил название за цвет простого вещества (от греческого хлорос – жёлто-зелёный).


Бром открыт в 1826 г. французским химиком Баларом. Элемент назван так за запах простого вещества (от греческого бромос – зловонный).


Йод получен в 1811 г. французским учёным Куртуа, а название он получил за цвет паров простого вещества (от греческого иодэс – фиолетовый).


Читайте также:

