Какой элемент относится к неметаллам кальций магний фосфор ксенон
Обновлено: 30.06.2024
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
Какие элементы периодической системы химических элементов Д И Менделеева относятся к Неметаллам?
Элементы-неметаллы: s-элемент – водород; р-элементы 13 группы – бор; 14 группы – углерод и кремний; 15 группы – азот, фосфор и мышьяк, 16 группы – кислород, сера, селен и теллур и все элементы 17 группы – фтор, хлор, бром, йод и астат.
Какие элементы металлы и неметаллы?
Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы. Неметаллы в обычных условиях находятся в твердом (фосфор, сера, селен, углерод и др.), жидком (бром) и газообразном (кислород, водород, азот и др.) состояниях.
Какие элементы относятся к P?
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка.
Где расположены химические элементы неметаллы в таблице Менделеева?
Неметаллы в периодической системе расположены в начале главных подгрупп, начиная с третьей группы и конце периодов, т. е. в правой верхней части периодической системы.
Сколько металлов и сколько неметаллов расположено в Псхэ?
Водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, германий, мышьяк, селен, бром, криптон, йод, ксенон, астат, радон - всего 22 элемента.
Где расположены элементы металлы в таблице Менделеева?
В периодической системе Менделеева металлы расположены ниже диагонали бор-астат. Т. . Менделеева провести условную диагональ между бором (B) и астатом (At), то по левую сторону от этой диагонали будут располагаться металлы. Они занимают главные подгруппы I-III групп, и всю побочную подгруппу.
Какие химические элементы являются металлом?
- Щелочные (например: Литий, Натрий, Калий)
- Щёлочноземельные (например: Кальций, Стронций, Барий) .
- Переходные (например: Уран, Титан, Железо, Никель, Кобальт, Молибден, Вольфрам, Платина)
- Постпереходные:
Какие химические элементы относятся к металлам?
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Где находятся металлы и неметаллы в таблице Менделеева?
Они имеют разные свойства (например, разный цвет), но совсем не похожи на металлы. В нашей периодической таблице символы неметаллов красные, а металлов – синие. Если провести диагональ примерно из левого верхнего угла в правый нижний, то элементы главных подгрупп выше диагонали будут неметаллами, а ниже – металлами.
Что означает химический элемент P?
p-элементами называют химические элементы, в атомах которых электрон с наивысшей энергией занимает p-орбиталь. p-элементами являются: в 1-м периоде — нет p-элементов во 2-м периоде — B—Ne.
Какие элементы относятся к s элементам?
- щелочные металлы,
- щелочноземельные металлы,
- водород и гелий.
Какие элементы относятся к D элементам?
К d-элементам относят те элементы, атомы которых содержат валентные электроны на (n – 1)d ns-уровнях и составляют побочные (IIIВ–VIIВ, IВ, IIВ) подгруппы, занимая промежуточное положение между типичными s-металлами (IА, IIА) и p-элементами.
В каком виде встречаются Неметаллы в природе приведите примеры?
В свободном виде в природе встречаются благородные газы, кислород, азот, сера, углерод, мышьяк. Часть неметаллов встречается в природе в виде соединений, в которых проявляет только положительные степени окисления. К ним относятся фосфор, кремний, германий, бор и некоторые другие.
Какие неметаллы имеют более высокую электроотрицательность?
Наиболее высокую электроотрицательность имеют неметаллы, положение которых приходится на правый верхний угол в Периодической системе, то есть галогены фтор и хлор, а также кислород. Именно эти элементы могут образовывать ионные связи.
s-Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок.
Что такое s-элементы?
К s-элементам относятся:
- щелочные металлы,
- щелочноземельные металлы,
- водород и гелий.
S-элементы отличаются тем, что в невозбужденном состоянии высокоэнергетичный электрон атомов находится на s-орбитали. Исключая водород и гелий, эти электроны очень легко отщепляются и формируются в положительные ионы при химической реакции. Конфигурация гелия химически стабильна; за счёт этого его относят к инертным газам.
S-элементы (кроме гелия) являются сильными восстановителями и поэтому в свободном виде в природе не встречаются. Элемент в металлическом виде может быть получен только с помощью электролиза расплава соли. Гемфри Дэви, в 1807 и 1808 году, стал первым, кто выделил s-металлы из их солей, за исключением лития, бериллия, рубидия и цезия. Бериллий был впервые выделен из солей независимо двумя учёными: Ф. Вулером и А. А. Бази в 1828 году, в то время как литий был выделен Р. Бунзеном только в 1854 году, который, после изучения рубидия, выделил его спустя 9 лет. Цезий не был выделен в чистом виде вплоть до 1881 года, до того, как Карл Сеттерберг подверг электролизу цианид цезия.
2. Известно, что для элементов одной группы характерно одинаковое число электронов на внешнем электронном слое. Выберите те элементы - неметаллы, атомы которых имеют 5 электронов на внешнем слое: азот, сера, магний, фосфор, алюминий, мышьяк.
…………………………………………………………………………………………
3. Самый активный неметалл в Периодический системе Д. И. Менделеева находится правом верхнем углу таблицы и в 7 группе. Что это за неметалл?
4. Перечислите несколько физических свойств, которые присуще неметаллам:
5. Неметалл сера находит широкое применение в практической деятельности человека. Приведите примеры.
6. Какой из неметаллов не относится к группе галогенов: хлор, бром, сера, фтор, иод?
…………………………………………………………………………………………
7. Водный раствор аммиака чаще всего называют нашатырным спиртом. Какая химическая формула данного соединения?
8. Перечислите кислородные соединения азота.
9. Фосфат кальция имеет несколько названий. Это химическое вещество является и горной породой, и удобрением. Назовите другие распространенные названия этого вещества.
10. Графит и алмаз имеют одну и ту же химическую формулу и образованы одним и тем же химическим элементом. Что это за элемент? Чем отличаются эти два простых вещества и где находят применение.
11. Хрусталь, цемент, керамика, фарфор, цветное стекло, оконное стекло, растение хвощ, хитиновый покров насекомых содержат одно и тоже вещество. Что это за вещество? Напишите его химическую формулу и назовите хотя бы одно название физического тела, которое содержит это вещество.

6 Смотреть ответы Добавь ответ +10 баллов

Ответы 6


1) быстро снять одежду то есть устранить одежду, аксессуары, которые находятся вблизи пораженного участка. Не стоит пытаться снять их привычным иначе появляется риск повреждения раневой поверхности тканью или металлом. Лучше аккуратно разрезать одежду, устранить ее, избегая лишнего трения.(Б)
2)смыть химическое вещество большим количеством воды до исчезновения специфического запаха. (Длительно (от 15 минут) промывать рану проточной холодной водой. Чем масштабнее участок поражения, тем обильнее и дольше происходит промывание. В случаях высокой степени повреждений на это уходит около 1 часа).(В)
3)Наложить сухую свободную стерильную повязку. Лучше использовать бинт или марлю. Повязка не должна туго стягивать плоть. Ее основная функция – предотвратить попадание болезнетворных бактерий на открытую рану руки, ноги или туловища.(Г) на повреждённые участки кожи наложить чистую повязку.)
4)Если химия попала внутрь пищевода или желудка, ее необходимо нейтрализовать обильным питьем воды или молока. Принятие жидкости при отравлении вызовет рвотный спазм, что ускорит процесс выведения токсина из полости пищевода. Нужно следить, чтобы рвотные массы не заполнили дыхательные пути. Больного лучше расположить человека на бок, открыть ему рот.
Объяснение:(вариант А) точно не подойдёт ну это смотря если химия попала внутрь а если нет то можно .

В главной подгруппе пятой группы, наряду с азотом, находится еще и фосфор. Металлом или неметаллом можно считать этот элемент? По сравнению с азотом он имеет более низкую электроотрицательность, однако все же относится к активным неметаллам. В нашей статье мы рассмотрим важнейшие физические и химические свойства фосфора, а также определим области его применения в промышленности.
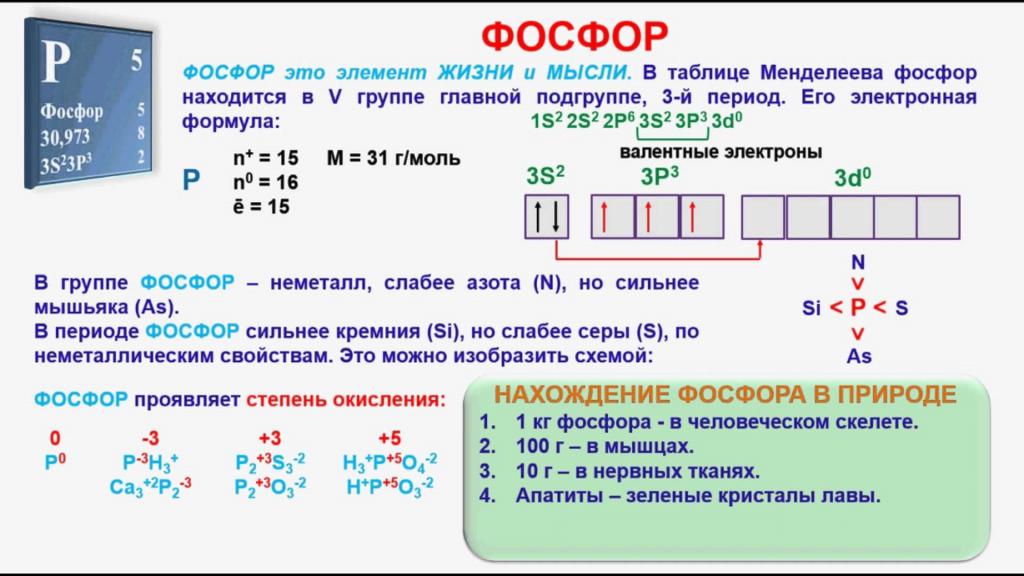
Положение элемента в периодической системе
Фосфор относится к p-элементам, его атом имеет три энергетических уровня. На последнем из них расположено пять электронов, три из которых являются неспаренными. В возбужденном состоянии атом P содержит пять свободных электронов. Этот факт объясняет появление соединений фосфора, в которых он не трехвалентен, но имеет валентность, равную пяти, например, P2O5 – пятиокись фосфора. Неметалл, вследствие своей высокой активности, в природе отсутствует в свободном состоянии и встречается только в виде соединений. Природный элемент имеет единственный стабильный изотоп с относительной атомной массой, равной 31. Фосфор входит в состав многих горных пород и минералов, его содержание в составе земной коры составляет 0,08%.

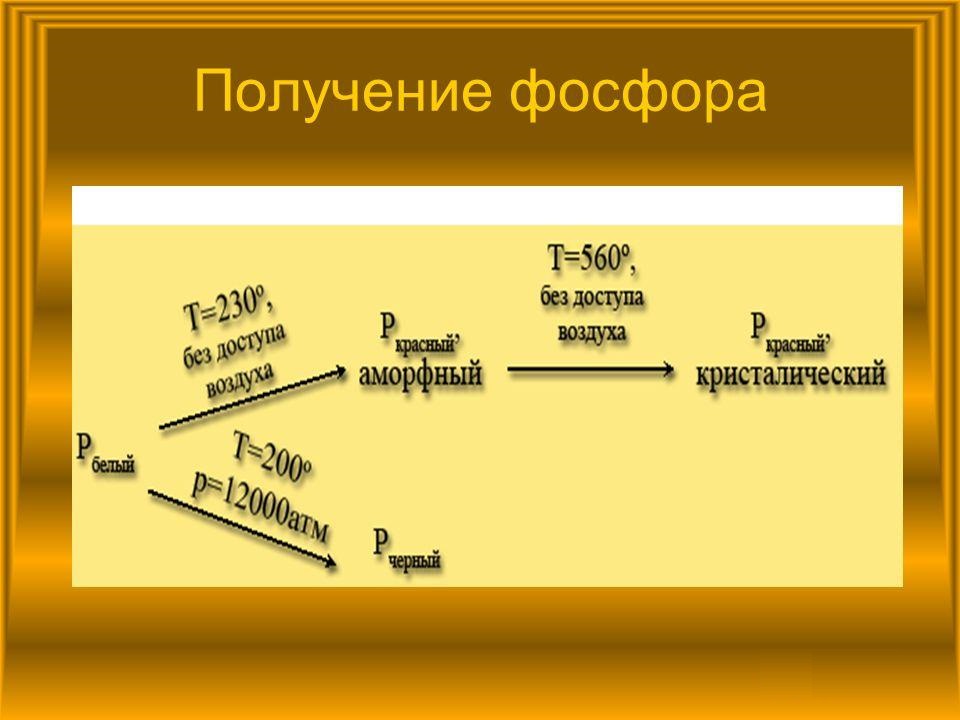
Аллотропные модификации
Различное расположение атомов в кристаллических решетках вещества приводит к появлению некоторых видоизменений. Например, черный фосфор очень напоминает графит. Он такой же жирный на ощупь и проявляет полупроводниковые свойства. В промышленности материал получают из белого фосфора, нагревая последний до 200°С и подвергая давлению в 12000 атм.
Красный фосфор – это порошковидное неядовитое вещество. При его детальном изучении было установлено, что соединение представляет собой смесь видоизменений фосфора, которые различаются между собой некоторыми признаками, например, цветом.
Еще одна аллотропная модификация – белый фосфор. Металлом или неметаллом он является? Это вещество проявляет типичные неметаллические свойства, кроме того, оно очень токсично. Получают его, концентрируя пары фосфора. В отличие от красного вида, он может растворяться в сероуглероде. Если белый фосфор длительно подвергать слабому нагреванию, он переходит в модификацию красного фосфора.
Химическая характеристика
В своих соединениях с другими элементами P может проявлять следующие степени окисления: +3, +5, -3. В парообразном состоянии при температуре ниже 800°, а также в жидкой фазе молекула вещества имеет формулу P4.
Различные модификации вещества имеют непохожие химические признаки. Как ответить на вопрос, чем является фосфор – металлом или нет? Нужно обратиться к строению его атома, который в возбужденном состоянии имеет пять валентных электронов. Наиболее активным в химическом плане неметаллом будет белый фосфор, который уже при обычной температуре легко окисляется, в процессе чего начинает светиться, а также может самовоспламеняться. По этим причинам его рекомендуется хранить покрытым водой. Красный фосфор по своим свойствам является менее активным веществом, чем его белая модификация.
Бинарные соединения
Как металл или неметалл, фосфор может реагировать с кислородом:
Продуктом реакции является газообразный фосфин – очень токсичное вещество, применяемое в качестве химического оружия. Его легко распознаеть по специфическому запаху чеснока. Гидрид фосфора способен присоединять галогеноводороды, например, такие, как йодоводород, образуя соединение – йодид фосфония PH4I. Взаимодействие с металлами приводит к появлению фосфидов:
Как металл, фосфор реагирует и с неметаллами, например, с серой, углеродом, хлором:
Фосфиды легко вступают в реакцию с водой, разлагаясь до фосфина:
Оксиды
Среди бинарных соединений элемента с кислородом наиболее важными являются его оксиды: P2O5 и P2O3. Триокись фосфора, иначе называемая фосфорным ангидридом, представляет собой кристаллическое соединение, температура плавления которого – 22,5°. В обычных условиях оно имеет вид воскоподобной массы. В лаборатории его получают сжиганием фосфора в атмосфере, бедной кислородом. Хотя этот оксид и проявляет свойства сильного восстановителя, применяется он крайне редко из-за высокой токсичности. Какие же свойства, металла или неметалла, фосфор оксид проявляет в своих реакциях? Он может реагировать с водой, образуя ортофосфорную кислоту и фосфин. Вещество взаимодействует с хлороводородом, в результате получаются фосфатная кислота и хлорид фосфора.
Другое соединение – пятиокись фосфора, имеет признаки типичного кислотного оксида. Его можно получить в результате сжигания порции фосфора в атмосфере с избытком кислорода. В обычных условиях с водой соединение реагирует очень активно и образует метафосфорную, а при нагревании – ортофосфорную кислоту. Кроме того, пятиокись фосфора отнимает влагу, поэтому может применяться в качестве осушителя для жидких веществ и газов.
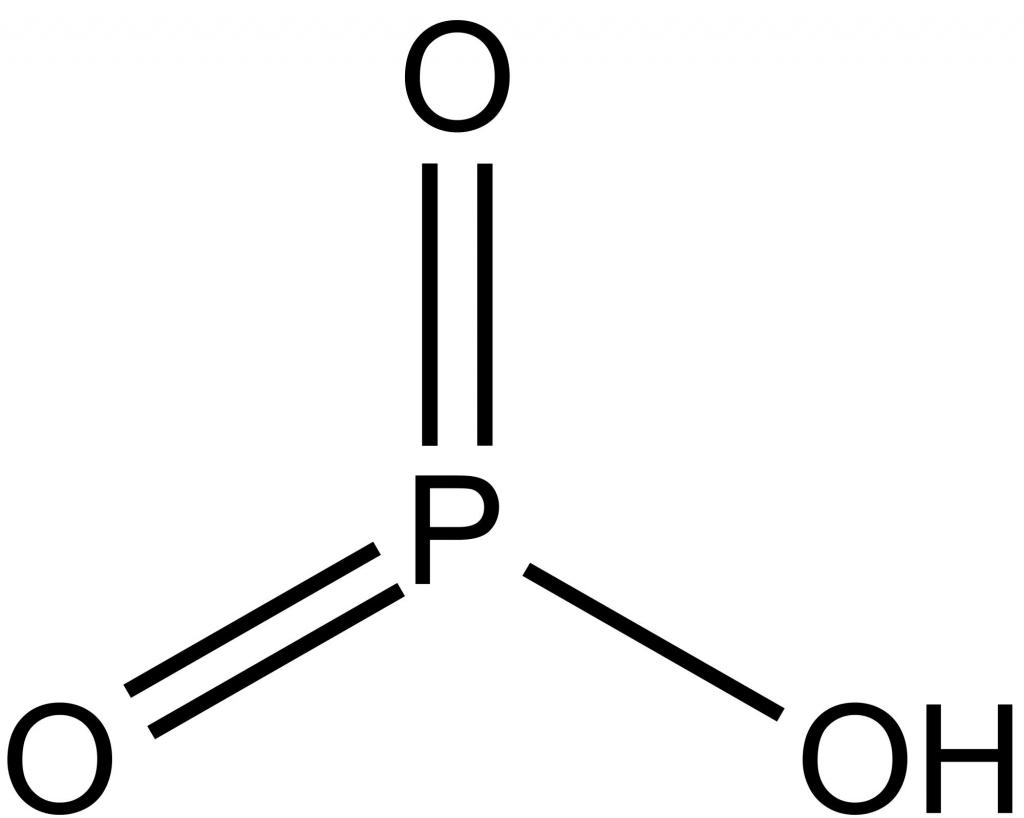
Фосфорные кислоты
Наиболее известные фосфорные кислоты – это метафосфорная, ортофосфорная и пирофосфорная, формула которой H4P2O7. Последняя из них образуется при нагревании H3PO4. Наибольшее практическое значение имеет ортофосфорная кислота, соли которой применяют в качестве сырья для получения минеральных удобрений. Она представляет собой твердое вещество белого цвета, очень хорошо растворимое в воде. Являясь кислотой средней силы, она не имеет ярко выраженных окислительных свойств. Как электролит, диссоциирует ступенчато, поэтому образует два ряда солей: средние – фосфаты, кислые – гидрофосфаты и дигидрофосфаты. В промышленности фосфатную кислоту получают термическим и экстракционным способом. Так как оксидам фосфора соответствуют кислоты, то на вопрос, чем является фосфор – металлом или неметаллом, ответ будет однозначным: это активный неметаллический элемент.

Распространение в природе
Наиболее важный минерал, содержащий высокую концентрацию фосфора – это апатит. Он имеет много разновидностей, самая распространенная из которых – фторапатит. Еще один вид минерала, состоящий из соединений фосфора – осадочная порода фосфорит.
Элемент входит в группу десяти важнейших для живых организмов химических элементов. Наибольшее его содержание обнаружено в форме фосфолипидов – органических соединений, которые входят в состав клеточных мембран, гормонов и других биологически активных веществ. Высокое содержание элемента (около 0,38%) регистрируется в нервной ткани, образующей центральный и периферический отделы нервной системы человека и других позвоночных животных. Кроме этого, соединения фосфора входят в мышечную и костную ткань. В последней присутствует фосфат кальция – соль, придающая дентину зубов и костям прочность и высокую твердость. В обмене веществ растительных организмов, наряду с магнием и железом, фосфор играет важную роль в качестве регулятора процессов формирования и созревания плодов и семян. Именно поэтому, вместе с азотом и калием, фосфор считается основным питательным элементом растений.

В нашей статье мы рассмотрели свойства фосфора и ответили на вопрос: чем является фосфор – металлом или неметаллом? Это типичный неметаллический элемент, обладающий высокой химической активностью.
Читайте также:

