Два моля одноатомного газа находящегося в цилиндре при температуре 200 к и давлении
Обновлено: 08.07.2024
За это задание ты можешь получить 3 балла. Уровень сложности: высокий.
Средний процент выполнения: 16.1%
Ответом к заданию 28 по физике может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Задачи для практики
Задача 1
Найдите плотность водорода при температуре 15◦С и давлении 730 мм рт. ст.
Решение
Плотность по определению равна: $ρ=/$(1), где $m$ - масса, $V$ - объем газа.
Из уравнения Менделеева-Клайперона имеем: $pV=/RT$ или $p=/$ или $p=/$, откуда $p=/$(2), где $T=t+273=(15+273)=288K$ - абсолютная температура. Зная, что 1мм.рт.ст. = 133 Па переведем давление в Паскали: $p=730·133=97090$Па, $μ=2·10^$кг/моль - молярная масса водорода, $R$ - универсальная газовая постоянная. Подставим числовые значения значения в (2) и получим: $p=<97090·2·10^>/=0.081кг/м^3$.
Задача 2
Автомобиль потребляет 10 л бензина на 100 км пути при скорости 108 км/ч. Определите КПД двигателя, если его мощность равна 50 кВт. Удельная теплота сгорания бензина 4,6 · 10 7 Дж/кг, плотность бензина ρ = 700 кг/м 3 .
Решение
Задача 3
Кусок свинца массой 2 кг нагрели, сообщив ему 110 кДж теплоты. Свинец расплавился на 50% своей массы. Какова была начальная температура свинца? Температура плавления свинца 600 К, удельная теплоёмкость свинца 130 Дж/(кг·К)
Решение
Общее количество теплоты, которое сообщили свинцу массой $m$ равно: $Q=Q_1+Q_2$ (1),
где $Q_1=cm(T_2-T_1)$ (2) - количество теплоты, которое сообщили свинцу до температуры плавления $T_2$.
$Q_2=m_2·λ=0.5m·λ$ (3) - количество теплоты, затраченное на плавление с учетом того, что расплавилось лишь 0,5 массы свинца.
$λ$ - удельная теплота плавления свинца, $c$ - удельная теплоемкость свинца.
Подставим (2) и (3) в (1): $Q=cmT_2-cmT_1+0.5mλ$, откуда найдем температуру $T_1$:
Задача 4
Газ в сосуде находится под давлением 300 кПа при температуре 227◦C. Определите давление газа после того, как половина массы газа выпущена из сосуда, а температура понижена на 80◦C.
Решение
Найдем абсолютную температуру $T_1$: $T_1=273+t_1=273+227=500K$, тогда $T_2=T_1-∆T=500-80=420K$,
Из уравнения Менделеева-Клайперона имеем:
$p_1·V=/RT_1$(1),
$p_2·V=/$(2), где $R$ - универсальная газовая постояннаяm, $μ$ - молярная масса газа. Разделим выражение (2) на (1): $/=/·/⇒p_2=/$(3). Подставим числовые значения в (3): $p_2=/=126·10^3=126$кПа.
Задача 5
Электрон прошёл ускоряющую разность потенциалов 100 В и влетел в однородное электрическое поле напряжённостью 2·10 3 В/м в направлении силовых линий поля. Определите расстояние, которое электрон пролетел до остановки.
Решение

Если разность потенциалов $U$ ускоряющая, то работа ускоряющего электрон поля $A_1=|q|U$ ($q=e$ - заряд электрона) равна увеличению кинетической энергии электрона: $E_к-E_=A$.
Кинетическая энергия после прохождения ускоряющей разности потенциалов: $E_к=/2$, где $m$ - масса электрона, $v$ - скорость, которую приобрёл электрон.
Так как начальная скорость равна нулю, начальная кинетическая энергия тоже равна нулю: $E_=0$.
Из (1) получим $/2=eU$
Когда электрон влетает в однородное электрическое поле, скорость его уменьшается до нуля, поскольку на него действует сила Кулона: $F_к=e·E$(2). Сила Кулона совершает работу: $A=-F_к·S$ (2), которая равна изменению энергии электрона $A=E_-E_к$ (3). Здесь $E_=0$ - конечная кинетическая энергия электрона (когда он остановился), $E_к=/2$ - найденная ранее кинетическая энергия электрона после прохождения ускоряющей разности потенциалов.
Приравняв (2) и (3) получим: $-e·E·S=-/2$ (4).
Приравняв (1) и (4), получим: $eE·S=eU⇒S=/$(3). Подставим числа: $S=/=/=0.05м=5$см.
Задача 6
Решение
Количество теплоты, которое получает пуля равно: $Q=cm·∆t$(2), где $c$ - удельная теплоемкость свинца, $c=140$Дж/кг·С.
По условию задачи: $Q=0.6·∆E_к$, откуда $∆t=/$(3). Подставим числовые значения в (3): $∆t=/·140>=150°C$. Поскольку $1°C=1K$, то $∆t=∆T=150K$
Задача 7
Два моля одноатомного газа, находящегося в цилиндре при температуре T1 = 200 К и давлении 2·10 5 Па, расширяется и одновременно охлаждается так, что его давление (p) в этом процессе обратно пропорционально объёму в кубе (V 3 ). Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A = 939,5 Дж, а его давление стало равным 0,25 · 10 5 Па?
Решение
1) Уравнение Менделеев-Клайперона: $pV=υRT$
Из уравнений Менделеева-Клапейрона для двух состояний газов: $/=/$. Тогда $T_2=/T_1=1/4T_1=1/4·200=50K$.
Значит газ отдал 2,8 кДж теплоты.
Задача 8
Два моля одноатомного газа, находящегося в цилиндре при температуре 400 К и давлении 4 · 10 5 Па, расширяются и одновременно охлаждаются так, что его давление в этом процессе обратно пропорционально объёму в кубе (V 3 ). Какую работу совершил газ при расширении, если он отдал количество теплоты 1979 Дж, а его давление стало равным 0,5 · 10 5 Па?
Решение
1) Первое начало термодинамики $-Q=∆U+A$, $∆U=/υRT$, по условию $p=/⇒V=/>$.
2) По закону Менделеева-Клайперона $pV=υRT$.
4) Таким образом $A=-Q-∆U=-1979-/·2·8.31(200-400)=5.5$кДж.
Задача 9
1 м 3 влажного воздуха при относительной влажности B = 60%, температуре T = 239 K и нормальном атмосферном давлении имеет массу M = 1,2004 кг. Определите давление насыщающего водяного пара при температуре T .
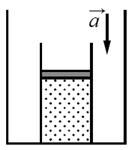
С1-1. На полу неподвижного лифта стоит теплоизолированный сосуд, открытый сверху. В сосуде под тяжёлым подвижным поршнем находится одноатомный идеальный газ. Поршень находится в равновесии. Лифт начинает равноускоренно опускаться вниз. Опираясь на законы механики и молекулярной физики, объясните, куда сдвинется поршень относительно сосуда после начала движения лифта и как при этом изменится температура газа в сосуде. Трением между поршнем и стенками сосуда, а также утечкой газа из сосуда пренебречь.
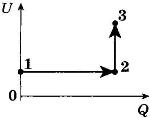
С1-2. В цилиндре, закрытом подвижным поршнем, находится идеальный газ. На рисунке показана диаграмма, иллюстрирующая изменение внутренней энергии U газа и передаваемое ему количество теплоты Q. Опишите изменение объема газа при его переходе из состояния 1 в состояние 2, а затем в состояние 3. Свой ответ обоснуйте, указав, какие физические закономерности вы использовали для объяснения.
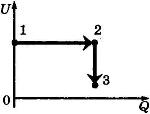
С1-2. В цилиндре, закрытом подвижным поршнем, находится идеальный газ. На рисунке показана диаграмма, иллюстрирующая изменение внутренней энергии U газа и передаваемое ему количество теплоты Q. Опишите изменение объема газа при его переходе из состояния 1 в состояние 2, а затем в состояние 3. Свой ответ обоснуйте, указав, какие физические закономерности вы использовали для объяснения.
С1-3. В цилиндре, закрытом подвижным поршнем, находится газ, который может просачиваться сквозь зазор вокруг поршня. В опыте по изотермическому сжатию газа его объем уменьшился вдвое, а давление газа упало в 3 раза. Во сколько раз изменилась внутренняя энергия газа в цилиндре? (Газ считать идеальным.)
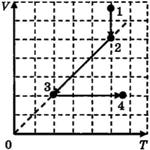
C1-5. Ha V T-диаграмме показано, как изменялись объём и температура некоторого постоянного количества разреженного газа при его переходе из начального состояния 1 в состояние 4. Как изменялось давление газа р на каждом из трёх участков 1—2, 2—3, 3—4: увеличивалось, уменьшалось или же оставалось неизменным? Ответ поясните, указав, какие физические явления и закономерности вы использовали для объяснения.
C1-6. В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают выдвигать из сосуда. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните, указав, какие физические закономерности вы использовали для объяснения.
С3-9. Нагреваемый при постоянном давлении идеальный одноатомный газ совершил работу 400 Дж. Какое количество теплоты было передано газу?
С3-11. В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 8 раз, давление воздуха в сосуде увеличилось в 2 раза, а его абсолютная температура увеличилась в 1,5 раза. Каково изменение внутренней энергии воздуха в сосуде? (Воздух считать идеальным газом.)
С3-12. В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 4 раза, давление воздуха в сосуде увеличилось тоже в 4 раза, а его абсолютная температура увеличилась в 1,5 раза. Каково изменение внутренней энергии воздуха в сосуде? (Воздух считать идеальным газом.)
С3-13. С разреженным азотом, который находится в сосуде под поршнем, провели два опыта. В первом опыте газу сообщили, закрепив поршень, количество теплоты Q1 = 742 Дж, в результате чего его температура изменилась на некоторую величину ΔT. Во втором опыте, предоставив азоту возможность изобарно расширяться, сообщили ему количество теплоты Q2 = 1039 Дж, в результате чего его температура изменилась также на ΔT. Каким было изменение температуры ΔT в опытах? Масса азота m = 1 кг.
С3-14. С разреженным азотом, который находится в сосуде под поршнем, провели два опыта. В первом опыте газу сообщили, закрепив поршень, количество теплоты Q1 = 742 Дж, в результате чего его температура изменилась на 1 К. Во втором опыте, предоставив азоту возможность изобарно расширяться, сообщили ему количество теплоты Q2 = 1039 Дж, в результате чего его температура изменилась также на 1 К. Определите массу азота в опытах.
С3-15. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление p = 4 • 10 5 Па. Расстояние от дна сосуда до поршня L = 30 см. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газа поршень сдвинулся на расстояние х = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтр = 3•10 3 H. Какое количество теплоты получил газ в этом процессе? Считать, что сосуд находится в вакууме.
С3-16. В горизонтальном цилиндрическом сосуде, закрытом подвижным поршнем, находится одноатомный идеальный газ. Давление окружающего воздуха р = 10 5 Па. Трение между поршнем и стенками сосуда пренебрежимо мало. В процессе медленного охлаждения от газа отведено количество теплоты │Q│ = 75 Дж. При этом поршень передвинулся на расстояние х = 10 см. Чему равна площадь поперечного сечения поршня? Количество вещества газа постоянно.
С3-17. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление газа р1 = 4 · 10 5 Па. Расстояние от дна сосуда до поршня равно L. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газ получил количество теплоты Q = 1,65 кДж, а поршень сдвинулся на расстояние х = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтp = 3 · 10 3 Н. Найдите L. Считать, что сосуд находится в вакууме.
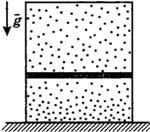
С3-18.Вертикальный замкнутый цилиндрический сосуд высотой 50 см разделен подвижным поршнем весом 110 Н на две части, в каждой из которых содержится одинаковое количество идеального газа при температуре 361 К. Сколько молей газа находится в каждой части цилиндра, если поршень находится на высоте 20 см от дна сосуда? Толщиной поршня пренебречь.

С3-19.В вертикальном теплоизолированном цилиндрическом сосуде под поршнем находится 0,5 моль гелия, нагретого до некоторой температуры. Поршень сначала удерживают, затем отпускают, и он начинает подниматься. Масса поршня 1 кг. Какую скорость приобретет поршень к моменту, когда поршень поднимется на 4 см, а гелий охладится на 20 К? Трением и теплообменом с поршнем пренебречь.
С3-20. Теплоизолированный сосуд объемом V = 2 м 3 разделен теплоизолирующей перегородкой на две равные части. В одной части сосуда находится 2 моль Не, а в другой — такое же количество моль А r . Температура гелия Т1 = 300 К, а температура аргона Т2 = 600 К. Определите парциальное давление аргона в сосуде после удаления перегородки.
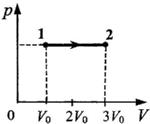
Термодинамика С3-21. На рисунке изображено изменение состояния 1 моль идеального одноатомного газа. Начальная температура газа 27° С. Какое количество теплоты сообщено газу в этом процессе?
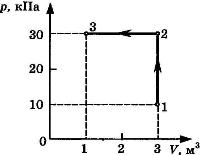
С3-23. На диаграмме представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
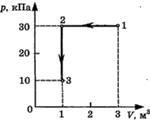
С3-24. На диаграмме представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
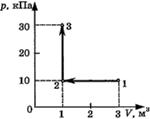
С3-25. На диаграмме (см. рисунок) представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
Начальная температура азота T1 и давление P1. Какое количество теплоты (в кДж, две значащие цифры, без округления) надо сообщить молям газа в замкнутом баллоне, чтобы его давление повысилось до P2 ?
= 3 ; T1 = 280 К; P1 = 220 кПа; P2 = 280 кПа
Какое количество теплоты необходимо сообщить газу, чтобы повысить его давление в 3 раза?
5)Один моль одноатомного газа, находится в закрытом баллоне при температуре 27С. Какое количество.
Какое количество теплоты нужно сообщить 2 молям воз¬духа, чтобы он совершил работу
Какое количество теплоты нужно сообщить 2 молям воз¬духа, чтобы он совершил работу в 1000 Дж: а).
Определите количество теплоты, которое необходимо сообщить газу, чтобы увеличить его давление.
Двухатомный идеальный газ (v=2 моль) нагревают при температуре 289 К. Определите количество.
Какое количество теплоты надо передать газу, чтобы нагреть его до 25°С?
Добрейшего времени суток) Имеется следующая задача: Цилиндр с подвижным поршнем имеет диаметр.
Определите количество теплоты, которое необходимо сообщить газу, что бы увеличить его давление
Двухатомный, идеальный газ ( v= 2 моль ) нагревают при постоянном объеме до температуры 289 К.
Найти количество теплоты, необходимое газу, чтобы его давление увеличилось в 3 раза
7.2 двухатомный идеальный газ 2 моль нагревают при постоянном объеме до Т=289 К. найти количество.
Какое количество теплоты надо затратить, чтобы нагреть азот на 10К?
В сосуде под поршнем находится масса 1г азота. Какое количество теплоты надо затратить, чтобы.
Какое количество теплоты нужно сообщить газу
Здравствуйте! Помогите, пожалуйста, решить задачу. В запаянном стеклянном баллоне заключен 1.
Вычислить количество теплоты, которое нужно сообщить одному молю газа Ван-дер-Ваальса
Всем привет очень нужна помощь видел подобную задачу у вас на форуме только там была Температура.
.jpg)
Репетитор по математике, физике (Минск): Виктор Иванович.
Математика, физика. Профессиональный репетитор (стаж более 20 лет + 6 лет курсы в БГУ). Подготовка к ЦТ, экзаменам. Бесплатно – проверка знаний. 1-й цикл занятий – ликвидация пробелов. 2-й цикл – решение тестов ЦТ. Занятия в Серебрянке, 1-2 чел. (90 мин) = 30 руб .
Тел: +375(29) 127 61 86.
Оказываю платные услуги: решение задач по физике. Оплата WebMoney.
Заказы направляйте сюда: Платные услуги
_______________________________________________________________________________________________
2.1. Основные законы идеальных газов.
2.2. Основы термодинамики.
2.3. Физика конденсированного состояния.
_______________________________________________________________________________________________
2.1. Основные законы идеальных газов.
2.1-1. В кусочке магния содержится 8,1 · 10 ² ⁴ атомов. Вычислите массу и количество вещества магния.
Решение:
M = 24 , 305 · 10 ⁻ ³ кг/моль (молярная масса магния)
N = 8 , 1 · 10 ² ⁴
Na = 6 , 022 · 10 ²³ 1/моль (постоянная Авогадро)
m – ?
ν – ?
Воспользуемся формулой для количества вещества ν :
ν = m / M = N / Na . (1)
Из (1) находим массу m и количество вещества ν
m = MN / Na ,
ν = N / Na .
m = 24 , 305 · 10 ⁻ ³· 8 , 1 · 10 ² ⁴ /(6 , 022 · 10 ²³ ) = 0 , 3269 кг,
ν = 8 , 1 · 10 ² ⁴ /(6 , 022 · 10 ²³ ) = 13 , 45 моль.
Ответ: m = 0,3269 кг, ν = 13,45 моль.
2.1-2. М олярная масса водорода М = 2 · 10 ⁻ ³ кг/моль. При нормальных условиях вычислить плотность водорода ( Р = 10 ⁵ Па, Nа = 6,02 · 10 ²³ 1/моль, R = 8,31 Дж/кг, t = 0 ⁰С ).
Решение:
M = 2 · 10¯³ кг/моль
P = 10⁵ Па
Na = 6,02 · 10²³ (1/моль)
R = 8,31 дж/кг
t = 0 ⁰С ( T = 273 K)
ρ – ?
Уравнение Менделеева-Клапейрона:
PV = mRT / M . (1)
Разделим (1) на V
P = mRT /( MV ). Но m / V = ρ (плотность). Тогда
P = ρRT / M , отсюда
ρ = PM /( RT ).
ρ = 10⁵ · 2 · 10¯³/(8,31 · 273) = 0,088 кг/м³
Ответ : ρ = 0,088 кг / м ³.
2.1-3. Газ в цилиндрическом сосуде разделен на две равные части подвижным поршнем, имеющим массу m и площадь сечения S . При горизонтальном положении цилиндра давление газа в каждой половине сосуда равно p . Определить давление p ₁ газа над поршнем при вертикальном положении цилиндра. Температура постоянна.
Решение:
m , S , p
T = const
p ₁ – ?
Пусть V – объём каждой части сосуда (горизонтальное положение).
При вертикальном положении сосуда поршень (имея массу) опустится. Объёмы каждой части станут:
V -∆ V – в нижней части сосуда ;
V +∆ V – в верхней части сосуда.
Изотермический процесс для газа в нижней части сосуда:
pV = ( p ₁ + mg / S )( V -∆ V ), (1)
где mg / S – давление поршня на газ в нижней части сосуда.
Изотермический процесс для газа в верхней части сосуда:
pV = p ₁( V +∆ V ). (2)
Разделим уравнения (1) и (2) на V :
p = ( p ₁ + mg / S )( 1-(∆ V / V ) ).
p = p ₁( 1+(∆ V / V ) ).
Обозначим x = ∆ V / V . Тогда последние два уравнения примут вид
< p = ( p ₁ + mg /S )(1- x ). (1′)
< p = p ₁(1 + x ). (2′)
(1′) и (2′) – система двух уравнений с двумя неизвестными p ₁ и x . Выразим x из (2′) и подставим в (1′). После преобразований, получим квадратное уравнение относительно неизвестной p ₁:
p ₁² + ( mg /S - p ) p ₁ - mgp /(2 S ) = 0. Решая его, получим:
p ₁ = (1/2)( p – ( mg /S ) ± √( ( mg / S )² + p ² ) ). (*)
(Под квадратным корнем стоит ( mg / S )² + p ² ).
Берём знак +, т.к. при m -> 0, p ₁ должно стремиться к p , что и следует из (*).
Ответ : p ₁ = (1/2)( p – ( mg / S ) + √( ( mg /S )² + p ² ) ) .
2.1-4. При увеличении абсолютной температуры идеального газа в 2 раза давление газа увеличилось на 25 процентов. Объем газа при этом: а) увеличился в 2 раза; б) не изменился; в) увеличился в 1,6 раз; г) уменьшился в 1,6 раз.
Решение:
T ₂ = 2 T ₁
P ₂ = 1,25 P ₁
V ₂/ V ₁ − ?
Уравнение Клапейрона
P ₁ V ₁/ T ₁ = P ₂ V ₂/ T ₂ или, с учётом условий задачи,
P ₁ V ₁/ T ₁ = 1,25 P ₁ V ₂/(2 T ₁) или V ₁ = 1,25 V ₂/2 отсюда
V ₂/ V ₁ = 2/1,25 = 1,6, т.е. объём увеличился в 1,6 раза.
Ответ: в) увеличился в 1,6 раз.
_______________________________________________________________________________________________
2.2. Основы термодинамики.
2.2-1. Слесарь обрабатывает напильником стальную деталь, производя 20 движений перемещая напильник на 20 см прилагая силу 10 Н. На сколько градусов нагреется деталь, если её масса 100 г, а 60% действий слесаря превращается в тепловую энергию?
Решение:
N = 20
L = 0,2 м
F = 10 Н
m = 0,1 кг
η = 0,6
c = 460 Дж/(кг · K) (удельная теплоёмкость стали)
∆t – ?
Коэффициент полезного действия (КПД) тепловых действий слесаря:
η = Q/A, (1)
где количество теплоты Q = mc∆t, работа A = NFL.
Тогда (1) примет вид:
η = mc∆t/(NFL),
отсюда
∆t = ηNFL/(mc).
∆t = 0,6 · 20 · 10 · 0,2/(0,1 · 460) = 0,52°C.
Ответ: ∆t = ηNFL/(mc) = 0,52 °C.
2.2-2. Мопед имеет мощность1,5 киловата и КПД = 25% и потребляет 1,8 кг. бензина на 100 км. С какой скоростью мопед проедет расстояние 100 км.?
Решение:
P = 1500 Bт
η = 0,25
m = 1,8 кг
S = 10⁵ м
q = 46,2•10⁶ Дж/кг (удельная теплота сгорания бензина)
V – ?
КПД мопеда:
η = P/P₁ (1)
где
P₁ = Q/t – затраченная мощность,
Q = mq – теплота, выделяющаяся при сгорании бензина,
t = S/V – время движения.
Тогда
P₁ = mqV/S
и (1) примет вид:
η = PS/(mqV),
отсюда
V = PS/(mqη).
V = 1500•10⁵/(1,8•46,2•10⁶ •0,25) = 7,22 м/c.
Ответ: V = 7,22 м/c.
2.2-3. Термодинамическая система совершает циклический процесс. Молярные теплоемкости процессов 1-2 и 3-4 равны соответственно С1 = 2 Дж/К и С2= 7 Дж/К. Процессы 2-3 и 4-1 адиабатические. Найти кпд цикла, если известно, что изменение абсолютной температуры системы в ходе процесса 1-2 больше изменения температуры при процессе 4-3 в четыре раза.
Решение:
C₁ = 2 Дж/K
C₂ = 7 Дж/K
Q₂₃ = Q₄₁ = 0
T₂ - T₁ = 4(T₃ - T₄)
η – ?
КПД цикла:
η = (Q₁ – Q₂)/Q₁ (1)
где
Q₁ = Q₁₂ = νC₁(T₂ - T₁) – энергия, поступившая в систему,
Q₂ = |νC₂(T₄ - T₃)| = (т.к. (T₄ - T₃) (C₁4 – C₂)/(C₁4).
Получили
η = (4C₁ – C₂)/(4C₁).
η = (4•2 – 7)/(4•2) = 0,125 = 12,5 %.
Ответ: η = 12,5 %.
2.2-4. Свинцовая пуля летит со скоростью 200 м / с и попадает в земляной вал. На сколько градусов нагревается пуля, если 78% кинетической энергии превратилось на внутреннюю?
Решение:
V = 200 м/с
Q = 0,78 W (1)
c = 130 Дж/(кг · K ) (удельная теплоёмкость свинца)
∆ T – ?
Кинетическая энергия пули
W = mV ²/2. (2)
Количество теплоты, полученной пулей
Q = mc ∆ T . (3)
Подставим (2) и (3) в (1)
mc ∆ T = 0,78 mV ²/2, отсюда
∆ T = 0,78 V ²/(2 c ).
∆T = 0,78 · 200²/(2 · 130) = 120 K.
Ответ: ∆T = 120 K .
2.2-5. В системе центрального отопления нагрев осуществляется пропусканием воды, поступающей в радиаторы при температуре 60°С и выходящей из них при температуре 37°С. Эта система заменяется другой, в которой нагрев производится паром, который при атмосферном давлении конденсируется в радиаторах, причем конденсат покидает радиаторы при температуре 82°С. Какое количество пара даст такой же эффект, что и 1 кг воды в первоначальной системе?
Решение:
t ₁ = 60⁰ C
t ₂ = 37⁰ C
c = 4190 Дж/(Кг · К) (удельная теплоёмкость воды)
m ₁ = 1 кг
t ₃ = 100⁰ C
t ₄ = 82⁰ C
L = 22,6 · 10⁵ Дж/кг (удельная теплота конденсации воды)
m ₂ – ? (масса пара)
Количество теплоты, отдающей водой
Q ₁ = m ₁ c ( t ₂ - t ₁).
Количество теплоты, отдающей паром
Q ₂ = - Lm ₂ + m ₂ c ( t ₄ - t ₃).
По условию
Q ₁ = Q ₂ или
m ₁ c ( t ₂ - t ₁) = - Lm ₂ + m ₂ c ( t ₄ - t ₃), отсюда
m ₂ = m ₁ c ( t ₂ - t ₁)/( - L + c ( t ₄ - t ₃) ).
m₂ = 1 · 4190 · (37 - 60)/( - 22,6 · 10⁵ + 4190 · (82 - 100) ) = 0,041 кг.
Ответ: m₂ = 0,041 кг .
2.2-6. Кислород массой 20 г, находящийся при температуре 640 К, сначала изохорно охлаждают так, что его давление уменьшается в два раза, а затем изобарно расширяют до первоначальной температуры. Найти работу, которую совершает газ.
Решение:
m = 0,02 кг
M = 0,032 кг/моль (молярная масса кислорода)
T ₀ = 640 K
R = 8,31 (универсальная газовая постоянная)
A − ?
Процесс изображён на рисунке.
Работа А = А₁₂ + А₂₃.
На изохорном участке 1→2 работа А₁₂ = 0.
На изобарном участке 2→3 работа равна площади прямоугольника ABCD
А₂₃ = AD · BA = ( V - V ₀) P ₀/2.
Тогда общая работа
А = ( V - V ₀) P ₀/2. (1)
Температура в точках 1 и 3 равна T ₁ = T ₃ = T ₀ .
Уравнение Менделеева-Клапейрона в точке 1
P ₀ V ₀ = ( m / M ) RT ₀ . (2)
Уравнение Менделеева-Клапейрона в точке 3
( P ₀/2) V = ( m / M ) RT ₀.
Приравняем левые части в последних двух равенствах
P ₀ V ₀ = ( P ₀/2) V , отсюда V = 2 V ₀ и подставим в (1)
А = (2 V ₀ - V ₀) P ₀/2 = V ₀ P ₀/2 и, с учётом (2),
А = mRT ₀/(2 M ).
А = 0,02·8,31·640/(2·0,032) = 1662 Дж.
Ответ: А = mRT₀/(2M) = 1662 Дж.
2.2-7. Идеальный одноатомный газ с количеством вещества 1 моль совершает процесс при котором давление растет пропорционально объему по закону P = aV . Газу сообщают количество теплоты 33,2 Дж. На сколько изменится температура газа?
Решение:
ν = 1 моль
P = aV
Q = 33,2 Дж
∆ T − ?
График процесса (отрезок CD ) представлен на рисунке. Первый закон термодинамики:
Q = ∆ U + A . (1)
Для идеального газа изменение внутренней энергии ∆ U :
∆ U = (3/2) νR ∆ T , (2)
где R = 8,3 Дж/(моль·К)– универсальная газовая постоянная.
Работа А газа на участке CD равна площади заштрихованной трапеции BCDE :
A = SBCDE = (1/2)( BC + ED )· BE = (1/2)( P ₁ + P ₂)·( V ₂ - V ₁) или
A = (1/2)( P ₁ V ₂ - P ₁ V ₁ + P ₂ V ₂ - P ₂ V ₁). ( A )
Точки O , C , D лежат на одной прямой; CB параллельно DE . Поэтому треугольники OCB и ODE подобны. Из подобия этих треугольников следует CB / DE = OB / OE или P ₁/ P ₂ = V ₁/ V ₂ , отсюда следует P ₁ V ₂ = P ₂ V ₁ и ( A ) упростится
A = (1/2)(- P ₁ V ₁ + P ₂ V ₂). ( B )
Уравнение состояния в точке С: P ₁ V ₁ = νRT ₁ . ( C )
Уравнение состояния в точке D : P ₂ V ₂ = νRT ₂ . ( D )
С учётом ( C ) и ( D ), ( B ) примет вид
A = (1/2)(- νRT ₁ + νRT ₂) = (1/2) νR ( T ₂ - T ₁) или
A = (1/2) νR ∆ T . (3)
Подставляя (2) и (3) в (1), получим
Q = (3/2) νR ∆ T + (1/2) νR ∆ T или Q = 2 νR ∆ T , отсюда
∆ T = Q /(2 νR ).
∆ T = 33,2/(2·1·8,3) = 2 K .
Ответ: ∆ T = Q /(2 νR ) = 2 K .
2.2-8. Температура идеального одноатомного газа в количестве 4 моль увеличилась на 300 К. На сколько увеличилась его внутренняя энергия?
Решение:
ν = 4 моль
∆ T = 300 К
∆ U – ?
Для идеального газа изменение внутренней энергии ∆ U :
∆ U = (3/2) νR ∆ T.
где R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
∆U = (3/2)·4·8,31·300 = 14958 Дж.
Ответ: ∆U = (3/2)νR∆T = 14958 Дж.
_______________________________________________________________________________________________
2.3. Физика конденсированного состояния.
2.3-1. Где вода закипает быстрее на вершине или у подножия горы, почему? Где температура будет меньше закипания?
Температура кипения воды в открытом сосуде у основания горы T₁ и на ее вершине Т₂ находятся в соотношении.
Решение:
Вода закипает быстрее на вершине т.к. там температура кипения (T₂) меньше чем у подножия горы (T₁).
Связь атмосферного давления P с температурой кипения Т:
P = nkT.
n – концентрация насыщенных паров в пузырьках кипящей воды,
k – постоянная Больцмана.
Имеем
P₁ = nkT₁ и P₂ = nkT₂.
Тогда
P₁/P₂ = nkT₁/( nkT₂) = T₁/T₂.
Получили
T₁/T₂ = P₁/P₂ .
Атмосферное давление внизу больше, чем на вершине P₁ > P₂, то и температура кипения внизу больше, чем на вершине T₁ > T₂.
Ответ: T₁ > T₂
_______________________________________________________________________________________________
Кроме того, первый закон термодинамики подразумевает состояние газа в системе в различных процессах идеальным, в связи с этим для состояния
данного газа используется известное уравнение Менделеева - Клапейрона:
PV = nRT
где n - число моль газа, R - универсальная газовая постоянная, равная 8,314 Дж/моль*К (в системе СИ)
Р - давление, V - объем. Если объем берется в м 3 , то давление измеряется в паскалях, если объем берется в литрах (дм 3 ), то давление берется в килопаскалях. Т - температура (обязательно в градусах Кельвина!).
Также используется понятие теплоемкостей:
Ср - изобарная мольная теплоемкость - количество теплоты, поглощенное телом (газом, жидкостью или твердым веществом) при нагревании 1 моль вещества на 1 градус при постоянном давлении.
Сv - изохорная мольная теплоемкость - количество теплоты, поглощенное телом (газом, жидкостью или твердым веществом)
при нагревании 1 моль вещества на 1 градус при постоянном давлении.
Для идеальных газов изобарная и изохорная теплоемкости связаны соотношением:
Ср = Сv + R
Кроме того, для одноатомного идеального газа изохорная теплоемкость равна:
Сv = 3/2R
Для двухатомного идеального газа:
Сv = 5/2R
Для трехатомных и многоатомных газов и нелинейных молекул изохорная теплоемкость может быть приблизительно рассчитана как:
Сv = 3R
(также все данные изобарных теплоемкостей можно найти в соответствующих справочниках)
В решении задач рассматривается поведение системы при различных изопроцессах.
Всего таких процессов 4:
1. Изобарный процесс.
Понятие изобарного процесса относится к поведению системы при неизменности давления газа в данной системе.
(Р = const)
Уравнение состояния идеального газа в данном случае запишется:
PΔV = nRΔT
V1/T1 = V2/T2
Количество теплоты, переданное системе (отданное системой) в данном процессе равно:
Q = nCp(T2 - T1)
Количество работы, совершенное при этом системой, равно:
А = P(V2 - V1)
2. изохорный процесс.
Понятие изохорного процесса относится к поведению системы при неизменности объема газа в данной системе.
(V = const)
Уравнение состояния идеального газа в данном случае запишется:
VΔP = nRΔT
P1/T1 = P2/T2
Количество теплоты, переданное системе (отданное системой) в данном процессе равно:
Q = nCv(T2 - T1)
Количество работы, совершенное при этом системой, равно нулю (что вытекает из физического смысла работы):
А = 0
3. изотермический процесс.
Понятие изотермического процесса относится к поведению системы при неизменности температуры газа в данной системе. (Т = const)
Уравнение состояния идеального газа в данном случае запишется:
ΔPΔV = nRT
V1Р1 = V2Р2
Количество работы, совершенное при этом системой, равно:
А = nRT*ln(Р1/Р2)
Количество теплоты, переданное системе (отданное системой) в данном процессе равно работе системы, так как изменения внутренней энергии газа не происходит:
Q = А
4. адиабатный процесс.
Понятие адиабатного процесса относится к поведению системы при отсутствии теплообмена газа в данной системе. (ΔQ = 0)
Уравнение состояния идеального газа в данном случае запишется:
PV γ = const
VT 1/(γ-1) = const
PT γ/(γ-1) = const
γ - отношение теплоемкостей газа:
γ = Ср/Сv
Исходя из данных уравнений, уравнение состояния идеального газа в данном случае называют уравнением адиабаты, и чаще всего используют в виде:
Т1V1 γ -1 = Т2V2 γ -1
Количество работы, совершенное при этом системой, равно:
А = nCv*(T1 - T2)
Согласно определению процесса, теплообмен с окружающей средой в данном случае отсутствует (Q = 0).
Рассмотрим решение задач, применительно к каждому процессу.
Находим число моль аргона:
n = m/M = 15 / 40 = 0.375 моль.
так как процесс нагревания газа - изобарный, то количество теплоты, пошедшее на нагревание аргона равно:
Q = nCp(T2 - T1)
так как аргон является одноатомным идеальным газом, то изобарная теплоемкость равна:
Ср = Сv + R
изохорная теплоемкость одноатомного идеального газа равна:
Cv = 3/2R
Отсюда, получим:
Ср = 3/2R + R = 1,5*8,314 + 8,314 = 20,785 Дж/моль*К
Количество тепла равно:
Q = 20,785*0,375*(318 - 288) = 233,83 Дж
Количество работы, совершенное системой, равно:
А = P(V2 - V1)
Так как начальный и конечный объем аргона неизвестен, то используем для решения уравнение Менделеева - Клапейрона применительно к данному процессу:
PΔV = nRΔT
P(V2 - V1) = nR(T2 - T1)
Получаем:
А = nR(T2 - T1) = 0,375*8,314*(318 - 288) = 93,53 Дж
Согласно первому началу термодинамики, изменение внутренней энергии системы равно:
ΔU = Q + A
Отсюда:
ΔU = 233,83 + 93,53 = 327,36 Дж
Задача 1.2
100 литров азота, находящегося при давлении 5 бар, изобарно охлаждают до объема 50 литров. Определить количество теплоты, работу и изменение внутренней энергии газа.
Решение.
так как процесс - изобарный, то количество теплоты, пошедшее на охлаждение равно:
Q = nCp(T2 - T1)
так как азот двухатомный идеальный газ, то изохорная теплоемкость равна:
Cv = 5/2R = 2,5*8,314 = 20,785 Дж/моль/К
изобарная теплоемкость равна:
Ср = Сv + R = 20,785 + 8,314 = 29,1 кДж/моль*К
Начальная и конечная температуры азота могут быть найдены из уравнения состояния идеального газа:
PV1 = nRT1
Т1 = PV1/nR
Т2 = PV2/nR
Получаем:
Q = nCp*(PV2/nR - PV1/nR) = nCp*P/nR*(V2 - V1) = Cp*P/R*(V2 - V1)
Давление переводим в килопаскали, так как объем указан в литрах: 1 бар = 10 5 Па = 10 2 кПа
Количество тепла равно:
Q = 29,1*5*10 2 /8,314*(50 - 100) = - 87503 Дж = - 87,5 кДж
Знак "-" в данном случае показывает что теплота поглощается.
Количество работы, совершенное системой, равно:
А = P(V2 - V1)
А = 5*10 2 *(50 - 100) = - 25000 Дж = - 25 кДж
Знак "-" в данном случае показывает что работа системы ведется против сжатия газа.
Согласно первому началу термодинамики, изменение внутренней энергии системы равно:
ΔU = Q + A
Отсюда:
ΔU = - 87,5 - 25 = - 112,5 Дж
Знак "-" в данном случае показывает что внутренняя энергия газа уменьшилась.
Решение.
находим число моль кислорода:
n(O2) = m/M = 64/32 = 2 моль
Работа при изохорном процессе равна 0, следовательно, изменение внутренней энергии газа равно количеству теплоты:
Q =ΔU
Количество теплоты в изохорном процессе рассчитывается:
Q = nCV(T2 – T1)
Для изохорного процесса (V = const) уравнение состояния идеального газа запишется:
P1V = nRT1
P2V = nRT2
P1/T1 = P2/T2 = nR/V
Так как начальное давление равно 101,3 кПа = 1 атм (нормальные условия) то конечная температура кислорода равна:
T2 = P2T1 / P1 = 2*273 / 1 = 546 0 К
Изохорная теплоемкость кислорода равна:
Сv = (5/2)R = 20,785 Дж/моль/К
Получаем:Q = ΔU = 2*20,785*(546 – 273) = 11348,61 Дж =11,35 кДж
Задача 2.2
Оксид азота (II) в количестве m=100 г занимает объем 100 литров. Определить теплоту работу и измерение внутренней энергии газа при изохорном нагревании до достижения давления от атмосферного до 2,5 атм.
Решение.
находим число моль NO:
n(NO) = m/M = 100/30 = 3,33 моль
Работа при изохорном процессе равна 0, следовательно, изменение внутренней энергии газа равно количеству теплоты:
Q =ΔU
Количество теплоты в изохорном процессе рассчитывается:
Q = nCV(T2 – T1)
Для изохорного процесса уравнение состояния идеального газа запишется:
P1V = nRT1
P2V = nRT2
Отсюда:
Т1 = P1V/nR
Т2 = P2V/nR
Получаем:Q = ΔU = Сv*(P2V/nR - P1V/nR) = Сv*V/nR*(P2 - P1)
NO - двухатомный идеальный газ, следовательно его изохорная теплоемкость равна:
Сv = (5/2)R = 20,785 Дж/моль/К
Давление переводим в килопаскали:
1 атм = 101,3 кПа
Атмосферное давление считается равным 1 атм, Р1 = 101,3 кПа, Р2 = 2,5*101,3 = 253,25 кПа
Теплота и измерение внутренней энергии равны:
Q = ΔU = 20,785*100*(253,23 - 101,3)/(3,33*8,314) = 11406,16 Дж = 11,41 кДж
Решение.
Согласно первому закону термодинамики
ΔU = Q – А
Изменение внутренней энергии газа в изотермическом процессе равно 0. ΔU= 0.
Работа в изотермическом процессе равна количеству теплоты и равна:А =Q =nRT*ln(P1 / P2) где P1 и P2 – давление газа в начале и конце процесса.
Так как расширяется 1 моль газа, то:
W =Q =RT*ln(P1 / P2)
Подставляя данные давления и температуры в градусах Кельвина, находим величину работы при изотермическом расширении:
W = 8,314*298*ln(100 / 5)= 7422,14 Дж = 7,42 кДж
Соответственно, количество теплоты подведенное к системе также равно 7,42 кДж.
Задача 3.2.
Хлор в количестве m=200г находится при температуре 25 0 С и давлении 101325 Па. Определить теплоту работу и измерение внутренней энергии газа при изотермическом расширении до объема V=0,16м 3 .
Решение.
Работа изотермического процесса расширения идеального газа равна:
А = Q =nRT*ln(P1 / P2)
Число моль хлора равно:
n = 200/71 = 2,82 моль.
Уравнение состояния идеального газа в изотермическом процессе запишется:
PV = const
P1V1 = P2V2
Р1 и Р2–давление газа в начале и конце процесса.
Конечное давление хлора определим из уравнения Менделеева –Клапейрона
PV = nRT
откуда
Р2 = nRT / V2
Т = 25 0 C = 298 0 К
Р2 = 2,82*8,314*298 / 0,16 = 43667,2 Па
Работа изотермического расширения равна:
А = 2,82*8,314*298*ln(101325 / 43667,2)= 5881 Дж = 5,88 кДж
Так как изменение внутренней энергии при изотермическом процессе равно 0, то количество теплоты при изотермическом расширении равно работе:
Q = А = 5,88 кДж
Работа при адиабатическом сжатии идеального газа рассчитывается по уравнению:
А = nCv*(T1 – T2) где n – число моль газа, Сv изохорная теплоемкость, Т1 и Т2– начальная и конечная температуры.
Так как адиабатическому сжатию подвергается двухатомный идеальный газ, то изохорная теплоемкость равна:
Сv = (5/2)R
Подставляя данные температур (предварительно переведя ее в градусы Кельвина), находим работу адиабатического сжатия:
А = 1*(5/2)*8,314*(288 – 298) = - 207,85 Дж
Знак "-" говорит о том, что работа отрицательна, так как газ сжимается.
Так как адиабатический процесс протекает без процесса теплообмена (Q = 0), то изменение внутренней энергии газа равно работе с обратным знаком:
ΔU = - А = 207,85 Дж.
Задача 4.2.
гелий в количестве 50 г находится при нормальных условиях. Определить работу и измерение внутренней энергии газа при адиабатическом расширении до объема 0,5 м 3 . Какой при этом окажется конечная температура газа?
Решение.
Число моль Не равно:
n(Не) = m/M = 50/4 = 12,5 моль
Работа адиабатного расширения равна:
А = - ΔU = nCV(T1 – T2)
Неизвестную температуру T2 определим, используя уравнение адиабаты:
Т1V1 γ -1 = Т2V2 γ -1
Так как γ = СР/СV, то находим γ.
Гелий является одноатомным газом.
Изохорная теплоемкость равна:
Сv = (3/2)R = 1,5*8,314 = 12,471 Дж/моль*К
Изобарная теплоемкость равна:
Ср = Сv + R = 12,471 + 8,314 = 20,785 Дж/моль*К
Получаем:
γ = 20,785 / 12,471 = 1,67
Первоначальный объем Не находим по данным условия. Так как первоначально гелий находится при н.у., то объем равен:
V1 = n(Не)*Vм = 12,5*22,4 = 280 литров = 0,28 м 3
Получаем:
Т2 = Т1V1 γ -1 / V2 γ -1 =273*0,28 0,67 / 0,5 0,67 = 273*0,426 / 0,629 = 185 0 К
То есть при адиабатном расширении до данного объема данное количество гелия охладится почти на 90 0 .
Находим работу адиабатного расширения:
А = 12,5*12,471*(273 – 185) = 13718,1 Дж = 13,72 кДж
Изменение внутренней энергии соответственно равно:
ΔU = - А = - 13,72 кДж
Отрицательное значение внутренней энергии, как раз говорит об охлаждении газа.
Читайте также:

