Температура газа в цилиндре постоянна запишите на основе
Обновлено: 18.05.2024
На этом уроке мы будем рассматривать круговые процессы, совершаемые с рабочим телом, в нашем случае – с идеальным газом. При этом рабочее тело на разных этапах участвует в различных квазистационарных процессах, переходя из одного равновесного состояния в другое, и в конечном итоге возвращается в исходное состояние. На диаграммах такие процессы изображаются замкнутыми линиями.
Устройство, в котором круговой процесс, изображенный на pV - диаграмме, идет по часовой стрелке, называют тепловой машиной. Поскольку изменение внутренней энергии при круговом процессе равно нулю (внутренняя энергия является функцией состояния), алгебраическая сумма количеств теплоты, подводимых к рабочему телу, равна работе, совершаемой рабочим телом за цикл (первый закон термодинамики ).
Если суммарное подводимое к рабочему телу количество теплоты обозначить через Q1 , а суммарное количество отводимого тепла через Q 2 , то работа, совершенная рабочим телом, равна
Эффективность работы тепловой машины принято характеризовать коэффициентом полезного действия (КПД):
Поскольку в случае тепловой машины Q1 > Q2 , то h 1.
Если круговой процесс происходит в обратном направлении, против часовой стрелки на pV - диаграмме, т.е. устройство работает как холодильная машина или тепловой насос, тепловые потоки изменяют свои направления: там, где раньше рабочее тело отдавало тепло, теперь получает его от внешнего резервуара, а там, где получало, теперь отдает тепло. Таким образом, уже не рабочее тело совершает работу, равную разности подводимых и отводимых количеств теплоты, а за счет внешней работы, совершаемой над рабочим телом, тепло, отбираемое от внешнего тела с меньшей температурой (холодильника), передается внешнему телу с большей температурой (нагревателю). Тепловой насос оказывается более эффективным устройством для обогрева помещений, чем электрические нагреватели с коэффициентом полезного действия в 100%. Количество тепла Q2 , полученное с помощью теплового насоса, равно
Q2 = A + Q1.
Получается, что КПД теплового насоса, работающего в качестве нагревателя, больше 100%. В свое время это обстоятельство очень удивило инженеров и обсуждалось в журнале “Техника – молодежи”. Несмотря на высокую тепловую эффективность тепловых насосов широкого применения в качестве обогревателей помещений они пока не получили. Еще не удалось найти хорошую конструкцию, достаточно простую, надежную и дешевую. Но изобретатели и инженеры продолжают свои поиски, и, возможно, в недалеком будущем, батареи центрального отопления в наших домах заменят тепловые насосы, перекачивающие тепло из морозного воздуха улицы внутрь теплой комнаты.
Перейдем к решению конкретных задач. Лучший способ изучения физики – решение задач по физики .
Задача 1 . На диаграмме зависимости давления p от объема V для некоторой массы идеального газа две изотермы пересекаются двумя изобарами в точках 1, 2, 3 и 4 (рис. 1). Найдите отношение температурТ3/Т1 в точках 3 и 1, если отношение объемов в этих точках V3/V1= a . Объемы газа в точках 2 и 4 равны .
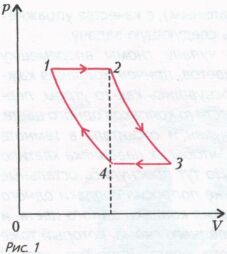
Рассмотрим изобарические участки.
Уравнение изобары имеет вид V/T = const.
Для состояний 1 и 2, и для состояний 3,4 имеем
где Т1 и Т2 – температуры газа на изотермах 4 – 1 и 2 – 3,а V1 и V2 – объемы газа в состояниях 1 и 2. Аналогичное соотношение для состояний 3 и 4 будет иметь вид
где V3 и V4 – объемы газа в состояниях 3 и 4. Добавим два очевидных соотношения и получим следующую систему уравнений:
Решать систему уравнений можно различными способами, но удобно из третьего и четвертого уравнений выразить отношение Т3/Т1 и равное ему Т2/Т1, перемножить почленно и получить
Задача 2 . На рисунке 2 для n молей гелия показан цикл, состоящий из двух участков линейной зависимости давления p от объема V и изобары. На изобаре 1–2 газ совершил работу А, и его температура увеличилась в 4 раза. Температуры в состояниях 1 и 3 равны. Точки 2 и 3 на pV-диаграмме лежат на прямой, проходящей через начало координат. Определите температуру газа в точке 1. Определите также работу газа за цикл.
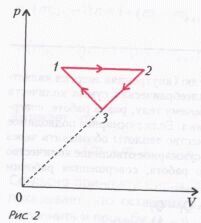
Обозначим температуру гелия в состоянии 1 через Т1, тогда температура в состоянии 2 будет равна 4Т1.
Пусть давление на изобаре 1-2 равно p1 , тогда работа, которую совершил газ при изобарическом процессе, равна
где V1 и V2 – объемы гелия в состояниях 1 и 2. Поскольку
Работу газа за цикл вычислим по площади треугольника 123: ,
где p3 – давление газа в состоянии 3.
Из уравнения состояния для идеального газа найдем
После подстановки значений V1 и V2 в выражение для работы газа за цикл получим
Так как на нашей pV -диаграмме точки 2 и 3 лежат на прямой, проходящей через начало координат, можно записать соотношение
Задача 3 . Найдите работу А, которую совершает моль гелия в замкнутом цикле, состоящим из адиабаты 1-2, изобары 2-3 и изохоры 3-1(рис. 3). В адиабатическом процессе разность максимальной и минимальной температур газа равна D Т. В изобарическом процессе от газа отвели количество теплоты Q.
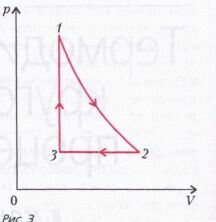
Обозначим температуры гелия в состояниях 1,2, и 3 через Т1,Т2, и Т3.
Рассмотрим адиабатический процесс 1-2. Процесс идет с увеличением объема газа, следовательно, газ совершает работу. В адиабатическом процессе работа, совершаемая газом, численно равна изменению внутренней энергии газа, взятому с противоположным знаком, следовательно, температура газа уменьшается. В состоянии 1 температура максимальна, а в состоянии 2 – минимальна, поэтому можно записать
Рассмотрим изобарический процесс 2-3. По первому началу термодинамики можно записать
где - молярная теплоемкость гелия при постоянном объеме, р2 – давление газа в изобарическом процессе 2-3. Отсюда с учетом соотношений и , получим
На изохорическом участке 3-1 работа газом не совершается, а увеличение внутренней энергии газа происходит за счет подвода тепла:
Работа, совершаемая молем газа в заданном цикле, равна
Задача 4. Газообразный гелий находится в цилиндре под подвижным поршнем. Газ нагревают при постоянном давлении, переводя его из состояния 1 в состояние 2 (рис. 4). При этом газ совершает работу А12. Затем газ сжимают в процессе 2-3, когда его давление р прямо пропорционально объему V. При этом над газом совершается работа А23 (А23 > 0).Наконец, газ сжимается в адиабатическом процессе 3-1, возвращаясь в первоначальное состояние. Найдите работу сжатия А31, совершаемую над газом в адиабатическом процессе.
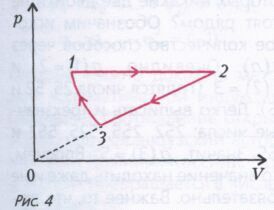
Введем обозначения: температуры и объемы в состояниях 1,2 и 3 обозначим через Т1, Т2 ,Т3 и V1, V2 и V3, давление на изобаре 1-2 через p1 , в состояниях 2 и 3 как p2 и p3 , работы на участках 1-2, 2-3 и 3-1 через А12, А23 и А31, n - число молей гелия.
Запишем выражения для работы на участках 1-2, 2-3 и 3-1.
На pV -диаграмме точки 2 и 3 лежат на прямой, проходящей через начало координат, следовательно,
и выражение для работы A23 приобретает вид
Полученную систему можно решать различными способами, но удобно выразить T2 –T1 из первого уравнения, T2 –T3 из последнего, получить T1 –T3 и подставить в А31. Окончательно имеем
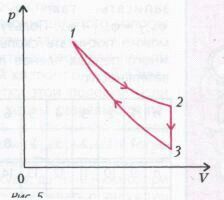
Задача 5 . КПД тепловой машины, работающей по циклу, состоящему из изотермы 1-2, изохоры 2-3 и адиабатического процесса 3-1 (рис. 5), равен h , а разность максимальной и минимальной температур газа в цикле равна D Т. Найдите работу, совершенную n молями идеального одноатомного газа в изотермическом процессе.
Нам задан КПД цикла, поэтому сначала разберемся, на каких участках цикла тепло подводится к газу, а на каких отводится.
На изотермическом участке 1-2 газ совершает работу (происходит увеличение объема), а поскольку внутренняя энергия газа не изменяется (почему?), то работа газа совершается за счет подвода тепла. Обозначим подведенное количество тепла через Q1 .
На изохоре 2-3 при постоянном объеме происходит падение давления. Очевидно, что это осуществляется за счет уменьшения температуры газа, и в этом случае тепло отводится от газа. Обозначим отведенное количество тепла через Q2 .
На адиабатическом участке 3-1 не отводится и не подводится, а с уменьшением объема над газом совершается работа, и его температура растет.
Следовательно, в точке 3 газ имеет наименьшую температуру Tmin , а максимальная температура Tmax газа была на изотерме 1-2. Таким образом,
Поскольку речь идет о КПД, запишем определение КПД замкнутого цикла:
На изотермическом участке . Тепло Q2 равно изменению внутренней энергии газа на участке 2-3, взятому с обратным знаком:
Решив эту систему уравнений, получим
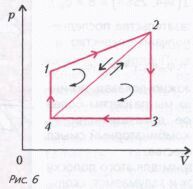
Задача 6 . КПД цикла 1-2-4-1 равен h 1, а цикла 2-3-4-2 равен h 2 (рис. 6). Найдите КПД цикла 1-2-3-4-1. Участки 4-1 и 2-3 изохоры, участок 3-4 изобара, участки 1-2 и 2-4 представляют линейную зависимость давления от объема. Все циклы обходятся по часовой стрелке. Рабочее вещество – идеальный газ.
Рассмотрим цикл 1-2-4-1. На участке 1-2 тепло подводится к газу (почему?). Обозначим подведенное количество теплоты через Q1. На участке 2-4 тепло отводится (почему?). Обозначим его через Q2. Подводимое (почему?) к газу на изохорическом участке 4-1 количество теплоты обозначим через Q3 . Если обозначить работу, совершаемую газом в этом цикле через А1, то КПД цикла равен
С другой стороны,
Теперь рассмотрим цикл 2-3-4-2. На участках 2-3 и 3-4 тепло отводится от газа (почему?). Подводится тепло только на участке 4-2 и подведенное количество теплоты, очевидно, равно Q2 . КПД данного цикла равен
где А2 – работа, совершаемая газом в этом цикле. Используя выражение для Q2 , можно записать
КПД цикла 1-2-3-4-1 равен
Выразив А1 и А2 из выражений для h 1 и h 2 , получим
Из Базового задачника задачи 8.94 –8.98.
Из Задачника для физиков:
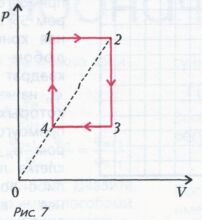
Задача 1 . На pV - диаграмме для некоторой массы идеального газа две изобары и две изохоры пересекаются в точках 1,2,3 и 4 (рис. 7). Найдите температуры газа Т 1 и Т 3 в точках 1и 3, если точки 2 и 4 лежат на прямой, проходящей через начало координат, а температуры газа в этих точках равны Т 2 и Т 4 соответственно .
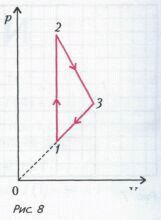
Задача 2 . Цикл для n молей гелия состоит из двух участков линейной зависимости давления от объема и изохоры (рис. 8). В изохорическом процессе 1-2 газу сообщили количество теплоты Q , и его температура увеличилась в 4 раза. Температуры в состояниях 2 и 3 равны. Точки 1 и 3 на pV -диаграмме лежат на прямой, проходящей через начало координат. Найдите температуру в точке 1 и работу газа за цикл.
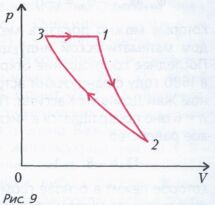
Задача 3 . Моль гелия совершает работу А в замкнутом цикле, состоящем из адиабаты 1-2, изотермы 2-3 и изобары 3-1 (рис. 9). Найдите работу, совершенную в изотермическом процессе, если разность максимальной и минимальной температур газа в цикле равна D Т.
Задача 4 . Газообразный гелий находится в цилиндре под подвижным поршнем. Газ сжимают в адиабатическом процессе, переводя его из состояния 1 в состояние 2. Над газом при этом совершается работа сжатия А 12 (А 12 > 0). Затем газ расширяется в изотермическом процессе 2-3, и наконец из состояния 3 газ переводят в состояние 1 в процессе, когда его давление прямо пропорционально объему. Найдите работу А 23 , которую совершил газ в процессе изотермического расширения, если во всем замкнутом цикле 1-2-3-1 он совершил работу А.
Ответ: .
Каким стало давление углекислого газа в цилиндре, если он был сжат при постоянной температуре от 6 до 4 л? Первоначальное давление газа было равно 10(5) Па
V1=6л=0,006 м^3. (Чтобы перевести литр в кубический метр - нужно разделить данный объем в литрах на 1000).
Запишем уравнение Менделеева - Клапейрона для двух случаев (Учитываем дано):
Где R - универсальная газовая постоянная, равная 8,31 Дж/(моль*К). А v - кол-во вещеста (кол-во углекислого газа).
Поделим первое уравнение на второе, получим:
\( \frac=1;\\ P1*V1=P2*V2;\\ P2=\frac;\\ \)
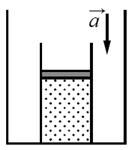
С1-1. На полу неподвижного лифта стоит теплоизолированный сосуд, открытый сверху. В сосуде под тяжёлым подвижным поршнем находится одноатомный идеальный газ. Поршень находится в равновесии. Лифт начинает равноускоренно опускаться вниз. Опираясь на законы механики и молекулярной физики, объясните, куда сдвинется поршень относительно сосуда после начала движения лифта и как при этом изменится температура газа в сосуде. Трением между поршнем и стенками сосуда, а также утечкой газа из сосуда пренебречь.
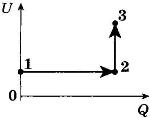
С1-2. В цилиндре, закрытом подвижным поршнем, находится идеальный газ. На рисунке показана диаграмма, иллюстрирующая изменение внутренней энергии U газа и передаваемое ему количество теплоты Q. Опишите изменение объема газа при его переходе из состояния 1 в состояние 2, а затем в состояние 3. Свой ответ обоснуйте, указав, какие физические закономерности вы использовали для объяснения.
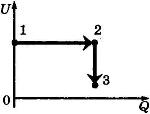
С1-2. В цилиндре, закрытом подвижным поршнем, находится идеальный газ. На рисунке показана диаграмма, иллюстрирующая изменение внутренней энергии U газа и передаваемое ему количество теплоты Q. Опишите изменение объема газа при его переходе из состояния 1 в состояние 2, а затем в состояние 3. Свой ответ обоснуйте, указав, какие физические закономерности вы использовали для объяснения.
С1-3. В цилиндре, закрытом подвижным поршнем, находится газ, который может просачиваться сквозь зазор вокруг поршня. В опыте по изотермическому сжатию газа его объем уменьшился вдвое, а давление газа упало в 3 раза. Во сколько раз изменилась внутренняя энергия газа в цилиндре? (Газ считать идеальным.)
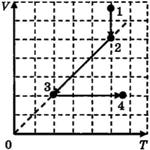
C1-5. Ha V T-диаграмме показано, как изменялись объём и температура некоторого постоянного количества разреженного газа при его переходе из начального состояния 1 в состояние 4. Как изменялось давление газа р на каждом из трёх участков 1—2, 2—3, 3—4: увеличивалось, уменьшалось или же оставалось неизменным? Ответ поясните, указав, какие физические явления и закономерности вы использовали для объяснения.
C1-6. В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают выдвигать из сосуда. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните, указав, какие физические закономерности вы использовали для объяснения.
С3-9. Нагреваемый при постоянном давлении идеальный одноатомный газ совершил работу 400 Дж. Какое количество теплоты было передано газу?
С3-11. В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 8 раз, давление воздуха в сосуде увеличилось в 2 раза, а его абсолютная температура увеличилась в 1,5 раза. Каково изменение внутренней энергии воздуха в сосуде? (Воздух считать идеальным газом.)
С3-12. В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 4 раза, давление воздуха в сосуде увеличилось тоже в 4 раза, а его абсолютная температура увеличилась в 1,5 раза. Каково изменение внутренней энергии воздуха в сосуде? (Воздух считать идеальным газом.)
С3-13. С разреженным азотом, который находится в сосуде под поршнем, провели два опыта. В первом опыте газу сообщили, закрепив поршень, количество теплоты Q1 = 742 Дж, в результате чего его температура изменилась на некоторую величину ΔT. Во втором опыте, предоставив азоту возможность изобарно расширяться, сообщили ему количество теплоты Q2 = 1039 Дж, в результате чего его температура изменилась также на ΔT. Каким было изменение температуры ΔT в опытах? Масса азота m = 1 кг.
С3-14. С разреженным азотом, который находится в сосуде под поршнем, провели два опыта. В первом опыте газу сообщили, закрепив поршень, количество теплоты Q1 = 742 Дж, в результате чего его температура изменилась на 1 К. Во втором опыте, предоставив азоту возможность изобарно расширяться, сообщили ему количество теплоты Q2 = 1039 Дж, в результате чего его температура изменилась также на 1 К. Определите массу азота в опытах.
С3-15. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление p = 4 • 10 5 Па. Расстояние от дна сосуда до поршня L = 30 см. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газа поршень сдвинулся на расстояние х = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтр = 3•10 3 H. Какое количество теплоты получил газ в этом процессе? Считать, что сосуд находится в вакууме.
С3-16. В горизонтальном цилиндрическом сосуде, закрытом подвижным поршнем, находится одноатомный идеальный газ. Давление окружающего воздуха р = 10 5 Па. Трение между поршнем и стенками сосуда пренебрежимо мало. В процессе медленного охлаждения от газа отведено количество теплоты │Q│ = 75 Дж. При этом поршень передвинулся на расстояние х = 10 см. Чему равна площадь поперечного сечения поршня? Количество вещества газа постоянно.
С3-17. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление газа р1 = 4 · 10 5 Па. Расстояние от дна сосуда до поршня равно L. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газ получил количество теплоты Q = 1,65 кДж, а поршень сдвинулся на расстояние х = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтp = 3 · 10 3 Н. Найдите L. Считать, что сосуд находится в вакууме.
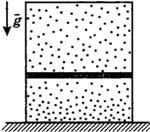
С3-18.Вертикальный замкнутый цилиндрический сосуд высотой 50 см разделен подвижным поршнем весом 110 Н на две части, в каждой из которых содержится одинаковое количество идеального газа при температуре 361 К. Сколько молей газа находится в каждой части цилиндра, если поршень находится на высоте 20 см от дна сосуда? Толщиной поршня пренебречь.

С3-19.В вертикальном теплоизолированном цилиндрическом сосуде под поршнем находится 0,5 моль гелия, нагретого до некоторой температуры. Поршень сначала удерживают, затем отпускают, и он начинает подниматься. Масса поршня 1 кг. Какую скорость приобретет поршень к моменту, когда поршень поднимется на 4 см, а гелий охладится на 20 К? Трением и теплообменом с поршнем пренебречь.
С3-20. Теплоизолированный сосуд объемом V = 2 м 3 разделен теплоизолирующей перегородкой на две равные части. В одной части сосуда находится 2 моль Не, а в другой — такое же количество моль А r . Температура гелия Т1 = 300 К, а температура аргона Т2 = 600 К. Определите парциальное давление аргона в сосуде после удаления перегородки.
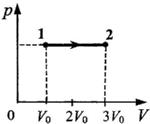
Термодинамика С3-21. На рисунке изображено изменение состояния 1 моль идеального одноатомного газа. Начальная температура газа 27° С. Какое количество теплоты сообщено газу в этом процессе?
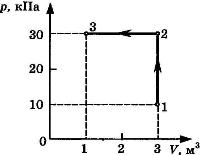
С3-23. На диаграмме представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
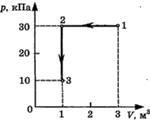
С3-24. На диаграмме представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
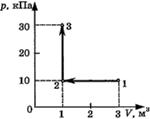
С3-25. На диаграмме (см. рисунок) представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
Если Вы не получили ответ на свой вопрос, то предлагаем воспользоваться поиском, чтобы найти похожие вопросы и ответы по предмету -> Физика. А если Вы знаете правильный ответ сами, то будем признательны если Вы ответите, воспользовавшись формой ниже.
Стерлинг – древняя английская серебряная монета, тождественная Римскому денарию. Современная денежная единица Великобритании – фунт стерлингов первоначально являлась только весовой нормой, обозначавшей, что 240 стерлингов должны иметь массу в 1 фунт…
Между островами Бали и Ломбок всего 15 миль. Максимальная глубина разделяющего пролива - 341 метр. Однако, несмотря на близкое соседство, на этих двух островах живут совершенно различные четвероногие животные, пресноводные рыбы и даже птицы. По остроумному замечанию одного ученого, эти острова отличаются своей фауной больше, чем Англия от Японии.
Социологи установили, что подняв с ковра нитку, которую не смог всосать пылесос, 85% мужчин бросают её обратно, чтоб дать пылесосу еще один шанс.
Краткая теория. Взаимодействие молекул идеального газа друг с другом происходит путём абсолютно упругих соударений. Суммарный объём молекул пренебрежимо мал по сравнению с объёмом, занимаемым газом. Идеальный газ подчиняется уравнению Клапейрона–Менделеева:
где p, V, T – соответственно давление, объём и абсолютная температура газа, m и M – масса и молярная масса газа, – универсальная (т.е. одинаковая для разных газов) газовая постоянная. Величина называется количеством вещества и выражается в молях. Эта величина, как и масса, аддитивна, т.е. суммируется. Поэтому уравнение (1) для смеси n газов примет вид
Молярная масса конкретного газа определяется по формуле , где Mr – определяемая по таблице Менделеева относительная молекулярная масса.
Закон сохранения и превращения энергии с учётом тепловых явлений – первое начало (закон) термодинамики: количество теплоты, подведённое к телу, равно изменению внутренней энергии тела плюс работе, совершаемой телом над внешними телами, т.е.
Задача 1. Два сосуда, содержащие один и тот же газ, соединены трубкой с краном. Объёмы сосудов равны V1 и V2, а давления в них p1 и p2. Каким будет давление газа после открытия крана соединительной трубки? Температура газа в обоих сосудах одинакова и не изменяется после открытия крана.
Решение. Запишем уравнение (1) для газа в обоих сосудах до открытия крана, а затем уравнение состояния газа в едином сосуде после его открытия. Эти уравнения образуют систему:
где m1 и m2 – массы газа в первом и втором сосудах соответственно. Сложив почленно первые два уравнения и сравнив получившееся уравнение с третьим, получим p(V1 + V2) = p1V1 + p2V2, откуда искомое давление
Задача 2. Газ, масса которого равна m1, а молярная масса M1, смешали с газом, масса которого равна m2, а молярная масса M2. Найдите среднюю молярную массу смеси.
Решение. Так как количество вещества смеси газов то искомая средняя молярная масса смеси Отметим, что полученная формула легко обобщается на случай смеси n газов:
Задача 3. Трубка длиной l, открытая с обоих концов, наполовину погружена в ртуть. Трубку сверху закрывают пальцем и вынимают из ртути. Чему равна длина столбика ртути, оставшегося в трубке? Атмосферное давление уравновешивается столбом ртути высотой H.
Решение. Пусть длина столбика ртути, оставшегося в трубке, равна x. Поскольку он находится в равновесии, то сумма действующих на столбик сил равна нулю: F1 + F2 + mg = 0. Здесь mg – сила тяжести, F1 и F2 – силы давления атмосферного и разреженного воздуха над ртутью соответственно.

Из векторного равенства вытекает скалярное: F1 = F2 + mg. Так как F1 = p1S, F2 = p2S, где S – площадь сечения трубки, – плотность ртути, то имеем:
По условию, тогда В последнем уравнении два неизвестных: x и p2. Значит, нужно ещё одно уравнение. Его нам даст закон Бойля–Мариотта, записанный для воздуха в верхней половине трубки: Исключая p2 из системы уравнений
приходим к квадратному уравнению:
с двумя положительными корнями:
Какой из них выбрать? Очевидно, что
Задача 4 (мехмат МГУ, 1988). На рисунке показан цикл, совершаемый над идеальным газом, причём участок 1–2 изображает изохорный процесс, 2–3 – изобарный. Температуры газа в точках 1 и 3 равны соответственно T1 = 300 К и T3 = 400 К. Найдите температуру T2 газа в точке 2. Масса газа постоянна.
Решение. Сначала запишем уравнение для трёх вершин треугольника:
Пользуясь рисунком, меняем индексы у величин p3 и V2:

Далее исключаем неизвестную величину , которую не требуется определять:
Осталось воспользоваться несколько скрытым условием задачи: точки 0, 1, 3 лежат на одной прямой, следовательно,
Но p3 = p2, следовательно, левые части уравнений в последней системе равны. Тогда равны и правые части: откуда T2 = 346 К.
Задача 5 (МГТУ им. Н.Э.Баумана). Посередине лежащего на боку заполненного газом запаянного цилиндрического сосуда длиной L = 1 м находится тонкий поршень массой m = 0,1 кг и площадью S = 10 см 2 . Если сосуд поставить на основание, то поршень перемещается на расстояние l = 1 см. Каково было начальное давление p газа в сосуде? Трение между стенками сосуда и поршнем отсутствует.
Решение. Рассмотрим сосуд в горизонтальном и вертикальном положениях. Запишем по закону Бойля–Мариотта два уравнения, дополнив их условием механического равновесия поршня:
Выразим из первого уравнения p1, из второго – p2 и подставим эти величины в третье уравнение. В результате найдём из линейного уравнения искомое неизвестное:
Задача 6. Зимой в комнате был включён электронагреватель мощностью 1 кВт, который работал 1 ч. Найдите изменение внутренней энергии воздуха в комнате.
Решение. Окружающий нас воздух представляет собой смесь двухатомных газов, если правомерно пренебречь ничтожной примесью инертных газов. Тогда внутренняя энергия воздуха
С учётом формулы (1) Объём комнаты V = const. А что будет с давлением? Отметим, что реальное жилище – не наглухо изолированный от внешнего мира бункер. Как только включили нагреватель, давление слегка повысится по сравнению с атмосферным. Воздух через мельчайшие щёлочки начнёт выходить из комнаты. Давления внутри и вне тут же сравняются. Так что и p = const. Но тогда и U = const, следовательно, изменение внутренней энергии А нагреватель включили не для увеличения внутренней энергии воздуха, а чтобы в комнате повысилась температура!
Задача 7 (физфак МГУ, 1977). Идеальный газ медленно переводят из состояния с объёмом V1 = 32 л и давлением p1 = 4,1•10 5 Па в состояние с объёмом V2 = 9 л и давлением p2 = 15,5•10 5 Па так, что давление во время сжатия изменяется в зависимости от объёма по линейному закону p = aV + b, где a и b – постоянные величины. При каком объёме температура газа в этом процессе будет наибольшей?
Решение. Имеем систему уравнений:
из которой последовательно исключаем b и a:
Из последнего уравнения и уравнения (1) легко вывести: Зависимость температуры от объёма представляет собой квадратичную функцию с отрицательным коэффициентом (при заданных значениях p1, V1, p2, V2) при старшем члене. Значит, наибольшее значение температуры достигается при
Задача 8. Некоторую массу m идеального газа с молярной массой M нагревают под поршнем так, что его температура, изменяясь пропорционально квадрату давления, возрастает от первоначального значения T1 до T2. Определите работу, совершённую газом.
Решение. Из системы уравнений

где выражаем давление:
где k = const. Видим, что давление прямо пропорционально объёму, т.е. непостоянно. В таком случае работа определяется с помощью интеграла:
Однако для линейных функций удобнее строить их графики в системе координат (p, V) и находить работу как площадь трапеции под графиком. По формуле площади трапеции (обычной, а не криволинейной):

Задача 9 (МФТИ, 1976). В цилиндре под лёгким поршнем находится m = 14 г азота при T = 300 К. Какое количество теплоты необходимо ему сообщить при изотермическом увеличении объёма на = 4%?
Решение. По первому началу термодинамики, Но в изотермическом процессе для идеального газа U = const, откуда Значит, Q = A.
При T = const вычислить работу без интеграла, вообще говоря, нельзя. Однако, учитывая, что в первом приближении заменяем криволинейную трапецию обычной.
Интересно сравнить приведённое решение с точным решением, полученным с применением интеграла:
Разлагая натуральный логарифм в ряд: – и ограничиваясь тремя первыми членами, получим
Читайте также:

