Интерферон лямбда эффективен против вирусов
Обновлено: 05.07.2024
Резюме: статья содержит актуальную информацию об этиологии, эпидемиологии, патогенезе и клинических проявлениях гриппа и ОРВИ. Особое внимание акцентируется на симптомах тревоги, являющихся безусловными показаниями для госпитализации. Тезисно обобщен опыт использования препарата рекомбинантного интерферона альфа^ для лечения и профилактики респираторных инфекций у детей. Даны практические рекомендации использования препарата Гриппферон® в амбулаторной практике.
Ключевые слова: грипп, ОРВИ, этиология, эпидемиология, патогенез, симптомы тревоги, рекомбинантный интерферон альфа-2Ь, лечение, профилактика, Гриппферон®
Summary: This paper presents current information on the etiology, epidemiology, pathogenesis and clinical manifestations of influenza and acute respiratory viral infections (ARVI). Particular attention is given to the warning signs that are unconditional indications for hospitalization. The experience with the recombinant interferon-based medication for the treatment and prevention of respiratory infections in children is summarised. Practical recommendations are provided for using the interferon-based medication Grippferon® in outpatient practice.
Keywords: influenza, ARVI, etiology, epidemiology, pathogenesis, warning signs, recombinant interferon alpha-2b, treatment, prevention, Grippferon®
Грипп и ОРВИ являются самой распространенной патологией, регистрируемой как среди детского, так и взрослого населения. Под более широким термином острые респираторные инфекции (ОРИ) объединена большая группа острозаразных болезней, характеризующихся преимущественным поражением слизистых оболочек дыхательных путей и проявлениями инфекционного токсикоза различной степени выраженности. Основным этиологическим агентом выступают вирусы, которые в детском возрасте, особенно в дошкольном и младшем школьном, вызывают 95% и более всех заболеваний верхних дыхательных путей.
Этиологическая структура ОРВИ многообразна и включает более 200 различных вирусов, среди которых следует выделить респираторно-синцитиальный вирус (РС-вирус), аденовирусы, вирусы парагриппа, вирусы гриппа А и В, риновирусы, энтеровирусы и коронавирусы. В настоящее время отмечается некоторое преобладание циркуляции вирусов парагриппа, аденовирусов и РС-вирусов. Вирус гриппа выделяется из этой многообразной группы высокой вирулентностью, низкой иммуногенностью и большой изменчивостью, кроме того, он обладает и выраженной контагиозностью [1].
Вирус гриппа А поражает как человека, так и многих животных и вызывает обычно среднетяжелый или тяжелый инфекционный процесс. Именно этот тип ответственен за возникновение тяжелых эпидемий и пандемий. Вирус гриппа В циркулирует только в человеческой популяции, преимущественно в детской, и с ним связаны локальные вспышки и ограниченные эпидемии, которые однако могут охватить несколько стран. Часто вспышки гриппа В совпадают с подъемом заболеваемости гриппом А или предшествуют ему. Вирус гриппа С до настоящего времени изучен мало. Известно, что он поражает только человека. Болезнь, вызванная вирусом гриппа С, обычно протекает легко и также часто совпадает с эпидемией гриппа А. Известно, что в результате точечных мутаций вируса гриппа происходит так называемый антигенный дрейф, приводящий к повышению заболеваемости, в том числе развитию эпидемии. Массивные изменения в генах гемагглютинина или нейраминидазы, обусловленные реассортацией генов вирусов гриппа разных подтипов, антигенный шифт вызывают развитие пандемии гриппа [2, 3]. Последняя пандемия гриппа 2009 г. была вызвана вирусом гриппа A/California/2009 (H1N1), который является тройным реассортантом и содержит генетические фрагменты разных штаммов: человеческого, птичьего и двух свиных [4].
Разумеется, у детей отмечаются респираторные инфекции и различной бактериальной этиологии, среди которых определенное место занимают микоплазмы и хламидии. Однако, несмотря на многообразие возбудителей, считают, что до 95% заболеваний верхних дыхательных путей в дошкольном возрасте вызываются вирусами, и их значение в формировании данной патологии является определяющим [5]. В более старшем возрасте нарастает доля других возбудителей, но именно вирусные инфекции, остаются ведущими, в том числе и у взрослых.
Распространенность ОРВИ, прежде всего, обусловлена локализацией возбудителей в эпителии верхних дыхательных путей и преимущественно аэрогенным механизмом передачи, который реализуется воздушно-капельным путем и является наиболее доступным для патогенных микроорганизмов. Следует заметить, что при многих ОРВИ главным путем распространения инфекции служит непосредственный контакт, когда возбудитель передается от человека к человеку, например, при рукопожатии. Длительность выживания инфекционных агентов во внешней среде с сохранением патогенных свойств зависит от ряда факторов, но для большинства возбудителей ОРВИ, в том числе и для вирусов гриппа, варьируется от нескольких часов до 7-12 дней [6].
Другими факторами высокой распространенности и различного уровня эпидемической заболеваемости ОРВИ являются большая плотность населения в городах, особенно крупных, проблема часто регистрируемого гиповитаминоза, неблагоприятные экологические факторы, недостаточно сбалансированное питание, курение (для детей пассивное) и несоблюдение правил гигиены. В связи с вышеизложенным заболеваемость респираторными инфекциями превалирует в холодное время года, как правило, в осенне-зимний и зимне-весенний период, но не является большой редкостью и летом.
Для того, чтобы произошло инфицирование, вирус гриппа должен преодолеть факторы неспецифической резистентности дыхательных путей. Главной мишенью вируса являются клетки цилиндрического реснитчатого эпителия верхних дыхательных путей, а также бокаловидные клетки (секретирующие слизь), альвеолоциты и макрофаги. Перечисленные клетки имеют на своей поверхности рецептор, с которым связывается вирусный гемагглютинин. Следует заметить, что разные типы вирусов гриппа А обладают различной способностью связываться с эпителием нижних дыхательных путей. Штаммы пандемического вируса гриппа А (H1N1)-swl обладают способностью вызывать тяжелые пневмонии. Проникновение вируса гриппа в клетки и последующая его репликация, сопровождающаяся выработкой многочисленных провосполительных факторов, вызывает цитолиз эпителиоцитов. Наличие токсикоза характерно для гриппа и обусловлено токсичными субстанциями вирусов и продуктами деградации клеточных структур, которые оказывают токсическое воздействие на сосудистую стенку, повышая ее проницаемость и ломкость сосудов, что влечет за собой нарушение микроциркуляции и может привести к развитию геморрагического синдрома. Микроциркуляторные расстройства приводят к развитию тканевой гипоксии и гипоксемии и могут повлечь за собой отек-набухание головного мозга и другие неотложные состояния. При массивной вирусемии возможно возникновение инфекционно-токсического шока с развитием сердечно-сосудистой недостаточности.
Элиминацию или уничтожение вирусов внутри клетки осуществляют многочисленные ферменты, индуцируемые интерферонами первого типа и контролирующие все стадии репродукции вирусов от сборки до выхода из клетки. Например, одним из продуктов индукции интерферона первого типа является Мх-белок, подавляющий активность вирусной РНК-зависимой РНК-полимеразы. Интерфероны первого типа влияют на развитие Th1 иммунного ответа, повышая жизнеспособность и пролиферативную активность Т-клеток, обеспечивая активацию противовирусного иммунитета. Таким образом, интерфероны первого типа несут важнейшую функцию на первом уровне защиты от вирусной инфекции, предупреждения тяжелых осложнений и становления устойчивого протективного иммунитета.
При парагриппе развивается катаральный ларинготрахеобронхит с преимущественным поражением гортани. Кроме дистрофических процессов и десквамации эпителия, образуются его очаговые разрастания, состоящие из нескольких слоев клеток. Также наблюдается лимфоидная инфильтрация и перибронхиальный отек. Возможно течение патологического процесса по варианту бронхиолита и пневмонии. Аденовирусы главным образом поражают носоглотку и альвеолы. В процесс вовлекается РЭС (синдром мононуклеоза), что способствует активации вторичной бактериальной флоры, особенно у детей раннего возраста. Для PC-вирусной инфекции характерно диффузное разрастание эпителия мелких бронхов, бронхиол и альвеолярных ходов, а также образование лимфоидных инфильтратов вокруг крупных бронхов и трахеи. В легких формируются небольшие ателектазы, чередующиеся с эмфиземой. В альвеолах накапливается густой экссудат, состоящий из макрофагов с примесью нейтрофилов и мелкозернистых масс белка. В просвете бронхиол и бронхов помимо экссудата определяются пласты слущенного эпителия. При поражении бронхов, кроме гиперплазии слизистой, имеют место отек, гиперсекреция и бронхоспазм, что способствует развитию обструкции. При риновирусной инфекции страдает слизистая оболочка полости носа 16.
В настоящее время при респираторной вирусной инфекции различной этиологии, в том числе и при гриппе, нередко может иметь место сочетанное поражение желудочно-кишечного тракта. Данный факт следует объяснить не только тропностью тех или иных вирусов, но и, вероятно, состоянием микробиоценоза кишечника, который в современной ситуации экологической нагрузки на детский организм близок к состоянию декомпенсации, проявляющейся в условиях заболевания ОРВИ.
Таким образом, для всех ОРИ характерны поражение слизистых оболочек дыхательных путей, снижение местной защиты и ослабление неспецифических факторов иммунитета. Проблема иммуносупрессии при инфекциях трахеобронхиальной системы очень актуальна, фактически у всех пациентов отмечена супрессия гуморального и клеточного иммунитета [17, 18].
С помощью самых современных методов лабораторной диагностики, при целенаправленных исследованиях, удается расшифровать не более 70% всех регистрируемых в детском возрасте острых заболеваний респираторного тракта. В настоящее время принято считать, что клинику ОРВИ вызывают около 200 (на самом деле еще больше) вирусов, поражающих дыхательные пути, в том числе и относящиеся к семейству Herpesviridae.
Если вести речь о практическом здравоохранении на уровне детской поликлиники, этиологическая верификация диагноза осуществляется крайне редко и для оказания медицинской помощи по сути значения не имеет. Врачу первого контакта очень важно сначала оценить состояние ребенка, степень тяжести заболевания для решения вопроса о необходимости госпитализации. В подавляющем большинстве случаев тяжелое течение инфекционного процесса формируется в первые-вторые сутки болезни и сопровождается соответствующей клинической симптоматикой и возможным развитием неотложных состояний.
Критериями тяжести заболевания является выраженность общего интоксикационного синдрома, нарушение сознания и фебрильные судороги, гемодинамическая нестабильность, проявляющаяся приглушенностью или глухостью сердечных тонов, появлением систолического шума в области верхушки сердца, ослаблением наполнения и напряжения пульса, падением АД, при перкуссии может выявляться расширение границ сердца. Острая сердечно-легочная недостаточность сопровождается одышкой при движении или в состоянии покоя, затрудненным дыханием, цианозом. При возможности пульсоксиметрии фиксируется снижение сатурации кислорода до 95-90%. К признакам тяжелого процесса также следует отнести боль в груди, кашель с окрашенной (кровянистой) мокротой. С первых дней болезни больные предъявляют жалобы на интенсивную головную боль и светобоязнь, интенсивность которых нарастает при движении глазных яблок. Превалируют признаки миалгии (болевые ощущения в мышцах - рабдомиолиз), боли локализуются чаще всего в ногах и поясничной области. Важно обращать внимание на отсутствие диуреза у ребенка более 4-х часов, что может быть признаком обезвоживания и также является свидетельством тяжелого течения болезни. При вышеизложенной клинической симптоматике показана срочная госпитализация.
Особо настораживающая симптоматика, требующая проведения интенсивной терапии в условиях ОРИТ: кровохарканье, боль в груди, резко выраженная одышка, судороги, нарушение сознания, снижение сатурации кислорода ниже 90%, синдром гематологических изменений, проявляющийся лейкопенией и тромбоцитопенией.
Более тяжело грипп протекает у детей с отягощенным преморбидным фоном - перинатальной патологией (родовые травмы, родовая асфиксия, пороки развития), различными хроническими заболеваниями, особенно сердечно-сосудистой и легочной системы, а также при сахарном диабете.
В ситуации, когда первоначально ребенок получает лечение амбулаторно, важно своевременно диагностировать возможное осложнение. В этом случае настораживающими симптомами является сохранение повышенной температуры тела (выше 37,5°C) более 7 дней, а также её повторное повышение, что является, чаще всего, проявлением бактериального осложнения, причем симптоматика, указывающая на конкретную область поражения, нередко отсутствует. Выраженная головная боль, особенно с рвотой и светобоязнью, непереносимость яркого света, тошнота, сонливость либо спутанность сознания, бред - признаки, свидетельствующие о вовлечении в патологический процесс ЦНС. При объективном осмотре выявляются ригидность затылочных мышц и/или другие симптомы мышечной ригидности. Одышка, затруднённое дыхание, боль в груди, особенно усиливающаяся при дыхании, гнойный или кровянистый характер мокроты говорят о неблагополучии со стороны легких, возможной пневмонии или позднем развитии ОРДС. Появление боли в ухе и в области придаточных пазух носа, насморка с выраженным гнойным отделяемым имеют место при отите и синуситах.
В то же время, понимая возможность формирования различных осложнений, врачу-педиатру необходимо не переоценивать возможную роль бактериальной флоры и воздерживаться от назначения антибиотиков в тех случаях, когда в этом нет необходимости. Уместно заметить, что назначение антибиотиков при вирусных респираторных инфекциях с профилактической целью не только этой цели не достигает, а напротив, способствует активации прежде всего резистентной к данному антибактериальному средству бактериальной флоры.
Показаниями к госпитализации детей при гриппе и ОРВИ являются тяжелые формы болезни и развитие осложнений, стеноз гортани независимо от степени выраженности. Наиболее серьезно следует относиться к вопросу госпитализации детей первого года жизни, учитывая возможность быстрой отрицательной динамики. По эпидемиологическим показаниям на стационарное лечение направляются дети, проживающие в закрытых детских учреждениях и неблагоприятных социально-бытовых условиях.
При гриппе противовирусная терапия должна назначаться как можно раньше с момента клинической манифестации, без ожидания лабораторной верификации диагноза, в идеале в первые 48 часов от начала болезни. Целью противовирусной терапии является уменьшение периода лихорадки и других симптомов и, что видится наиболее значимым, снижение риска развития осложнений [19]. Аналогичные задачи решает противовирусная терапия и при других вирусных инфекциях респираторного тракта.
Важную роль в противостоянии вирусным инфекциям играют интерфероны, семейство которых представлено тремя типами [21]. Все интерфероны обладают противовирусным, иммуномодулирующим, противоопухолевым и антипролиферативным эффектами. В организме интерфероны первого типа действуют на собственно выделившую их клетку и на расположенные поблизости. Основная причина постоянной выработки интерферонов на низком, но физиологически значимом уровне - поддержание готовности клеток противостоять вирусам. После связывания интерферона с рецептором клетки происходит образование транскрипционного комплекса ISGF3, состоящего из молекул транскрипции STAT1, STAT2, IRF9, активирующего пул генов, стимулируемых интерфероном. Именно эти гены и определяют противовирусный, иммуномодулирующий и антипролиферативный эффекты интерферонов. Достаточно пикомолярных концентраций интерферона первого типа для получения противовирусного воздействия на слизистые при профилактике и лечении гриппа и ОРВИ. Одними из наиболее эффективных средств, используемых при респираторных заболеваниях различной этиологии, являются препараты рекомбинантного интерферона первого типа (альфа-2а и -2b).
Интерферон альфа блокирует размножение всех видов человеческих респираторных вирусов, к нему отсутствует эффект привыкания, поскольку вирусы практически неспособны приобрести устойчивость к его действию. Интерферон не взаимодействует с вирусами напрямую, а блокирует механизм их воспроизведения. Биологическое действие интерферона характеризуется универсальностью, высокой активностью против многих ДНК- и РНК-содержащих вирусов. Кроме того, интерферон индуцирует выработку противовирусных антител, а также активирует моноциты и макрофаги 24.
Наиболее доступный и широко применяемый препарат рекомбинантного интерферона для интраназального введения - Гриппферон®, капли и спрей назальные. Более выраженное противовирусное местное действие Гриппферона обусловлено тем, что в его основе лежит оригинальная комбинация интерферона альфа-2Ь человеческого рекомбинантного с полимерными соединениями, составляющими водорастворимую вспомогательную часть препарата [26, 27]. Введение в состав препарата полимерных соединений обеспечивает продолжительный контакт интерферона со слизистой носовой полости, что способствует пролонгированному эффекту при защите организма от вирусной инфекции. В условиях in vitro доказан вирусингибирующий эффект Гриппферона в различных клеточных культурах на модели аденовирусной, коронавирусной, гриппозной инфекции и др.
Первый опыт клинического использования препарата Гриппферон® при ОРВИ относится к концу прошедшего тысячелетия, когда его начали применять как с лечебной, так и с профилактической целью [28, 29]. Заслуживает внимания возможность применения препарата у детей первого года жизни и беременных независимо от сроков гестации, поскольку именно для данных групп пациентов выбор назначаемых лекарственных средств существенно ограничен 30. На фоне использования Гриппферона у детей первого года жизни снижается необходимость назначения антибиотиков, а также вероятность возникновения повторных ОРВИ [33]. В проведенных исследованиях не отмечалось каких-либо аллергических реакций, в том числе и среди детей с проявлениями дермато-или респираторного аллергоза [30]. Значительный положительный эффект получен при использовании интраназальной формы рекомбинантного интерферона с целью профилактики у детей с частыми рекуррентными респираторными инфекциями [33]. С профилактической целью Гриппферон® применяли как в межэпидемический период, так и в периоды выраженного эпидемического подъема, в том числе в закрытых детских коллективах - среди детей, которым давали препарат, респираторные вирусные инфекции регистрировались редко [27, 34, 35].

Применение Тилорона-СЗ для профилактики и лечения гриппа и ОРВИ
Михайлов И.Б. дмн, профессор, член-корреспондент РАЕН, зав.курсом клинической фармакологии, Санкт-Петербугского государственного педиатрического медицинского университета.
Кафедра клинической фармакологии Санкт-Петербургского государственного педиатрического медицинского университета
Безусловно, важнейшими препаратами для лечения гриппа и ОРВИ являются противовирусные препараты, однако в некоторых случаях не обойтись и без антибиотиков, а также патогенетических и симптоматических лекарственных средств.

К числу традиционных противовирусных средств относят:
- Химиопрепараты (умифеновир, ингавирин, изопринозин, ремантадин, озельтамивир, занамивир и др.).
- Интерфероны (лейкоцитарный интерферон, гриппферон, виферон, генферон, реаферон и др.).
- Индукторы интерферона (тилорон-СЗ = амиксин и др.).
Правильно выбранные и вовремя назначенные противовирусные препарата
снижают степень тяжести заболевания и риск развития осложнений ОРВИ/гриппа, а также повышают выживаемость пациентов.
Что выбрать? Каковы недостатки и преимущества вышеназванных групп противовирусных препаратов?
Основные проблемы применения противовирусных химиопрепаратов:
В тоже время следует подчеркнуть, что противовирусные химиопрепараты – это препараты выбора при высокой степени тяжести инфекции. Они оказываю прямое действие на разные стадии репродукции конкретных вирусов, в случае их попадания в цель и раннего назначения.
Основные проблемы применения экзогенных интерферонов:
- Нет единого мнения инфекционистов о степени их эффективности, особенно в случае позднего применения. Известно, что все семейства респираторных вирусов обладают механизмами подавления интерферонового ответа.
- По принципу отрицательной обратной связи блокируют выработку собственных интерферонов.
- Низкий комплаенс.
- Высокая опасность возникновения аллергических реакций.
- Высокая стоимость.
- Отсутствие устойчивой доказательной базы для большинства препаратов.
В тоже время экзогенные интерфероны это универсальные
противовирусные препараты, они инициируют иммунную защиту против любых инфекционных агентов, а также следует отметить возможность их местно го назначения беременным женщинам, детям с самого раннего возраста и матерям, кормящим грудью.
Основные проблемы применения индукторов интерферонов:
- Тяжелые иммунодефицитные состояния. К счастью таких пациентов не много.
- Иногда отмечают недостаточную эффективность и скорость наступления эффекта при некоторых ОРВИ, что по-видимому связано с особенностями интерфероногенеза при разных ОРВИ.
В тоже время применение индукторов интерферонов сопровождается
целым рядом преимуществ:
Фармакодинамика. Тилорон-СЗ оказывает иммуномодулирующее и противовирусное действие. Он является низкомолекулярным синтетическим индуктором интерферона. Стимулирует образование в организме интерферонов бета, гамма, альфа, лямбда. После введения препарата интерферон продуцируют преимущественно клетки эпителия кишечника, Т-лимфоциты, гранулоциты, гепатоциты и нейтрофилы. После перорального приема Тилорона-СЗ максимум
продукции интерферона определяется в следующей последовательности: кишечник – печень – кровь (спустя 4–24 ч). После однократного приема внутрь максимальной суточной дозы Тилорона-СЗ для человека максимальная концентрация в легочной ткани интерферона лямбда определяется через 24 ч, интерферона альфа – через 48 ч. Интерферон лямбда в легочной ткани повышает противовирусную защиту респираторного тракта при гриппе и других респираторных вирусных инфекциях. Тилорон-СЗ индуцирует синтез интерферона в лейкоцитах человека, стимулирует стволовые клетки костного мозга. В зависимости от дозы препарат способен усиливать образование антител, уменьшать степень иммунодепрессии, восстанавливать соотношение Т-супрессоров и Т-хелперов. Механизм противовирусного действия Тилорона-СЗ обусловлен ингибированием трансляции вирус-специфических белков в инфицированных клетках, вследствие чего репродукция вирусов подавляется. Препарат эффективен при различных вирусных инфекциях, включая вирусы гриппа и другие острые респираторные вирусные инфекции (ОРВИ), герпесвирусы и многие другие.
Фармакокинетика. После попадания в желудочно-кишечный тракт
Тилорон-СЗ быстро всасывается. Его биодоступность составляет порядка 60%. С белками плазмы связывается 80%. Период полувыведения – 48 ч. Выводится преимущественно в неизмененном виде: через кишечник – 70%, почками – 9%. Тилорон-СЗ не подвергается биотрансформации. Не накапливается в организме.
Противопоказания: наследственная непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция; беременность; период лактации; детский возраст до 7 лет; наличие повышенной чувствительности к любому компоненту препарата.
Побочные действия. Тилорон-СЗ может вызвать кратковременный озноб, возникновение диспепсических расстройств и развитие аллергических реакций.
Передозировка. До настоящего времени о случаях передозировки неизвестно.
Особые указания. Не отмечено негативного влияния Тилорона-СЗ на когнитивные и психомоторные функции человека. Препарат не оказывает влияние на способность к управлению автотранспортом и сложными механизмами.
Показания к применению.
У взрослых: грипп и другие ОРВИ (лечение и профилактика), герпетическая инфекция.
У детей от 7 лет Тилорон-СЗ применяется для лечения ОРВИ, включая грипп.
Для взрослых:
Грипп и другие ОРВИ:
лечение – по 125 мг/сутки в первые два дня, далее – по 125 мг с интервалами 48 часов, суммарная курсовая доза – 750 мг;
профилактика – по 125 мг раз в неделю на протяжении 6 недель, суммарная курсовая доза – 750 мг.

Герпетическая инфекция: по 125 мг/сутки в первые два дня, далее – по 125 мг с интервалами 48 часов, суммарная курсовая доза – 1250–2500 мг.
Важное преимущество Тилорона-СЗ заключается в его хорошей способности подавлять размножение герпесвирусов. Вирусы семейства герпеса обладают способностью пожизненно персистировать в организме в латентном состоянии. Их реактивация и степень клинической выраженности вызванных ими заболеваний, определяется, в первую очередь, состоянием иммунной системы. Индуцируемые приемом Тилороном-СЗ -интерфероны контролируют раннюю, острую фазу репликации вируса, препятствуют его распространению, активируют макрофаги, NK-клетки, цитотоксические лимфоциты и таким образом, выступая медиаторами естественного противовирусного иммунитета, уменьшают вирусную нагрузку, приводящую к более распространенному и длительному течению заболевания. Продуцируемый впоследствии -интерферон обеспечивает длительный контроль за вирусной инфекцией и участвует в реализации адаптивного иммунного ответа. Применение индукторов эндогенного интерферона рассматривается в настоящее время как вариант современной стратегии терапии герпес –ассоциированных заболеваний.
Дозы для детей от 7 лет:
Неосложненные формы гриппа и других ОРВИ: по 60 мг раз в сутки в первый, второй и четвертый дни лечения. Суммарная курсовая доза – 180 мг.
Возникновение осложнений гриппа или других ОРВИ: по 60 мг раз в сутки в первый, второй, четвертый и шестой дни лечения. Суммарная курсовая доза – 240 мг.
Лекарственное взаимодействие. Тилорон-СЗ может применяться в рамках комплексной терапии совместно с антибиотиками и препаратами, традиционно назначаемыми для лечения бактериальных и вирусных инфекций.
Сроки и условия хранения. Хранить в месте, недоступном для детей, сухом, защищенном от света, при температуре до 25 °С. Срок годности таблеток – 3 года, капсул – 2 года.
Тилорон-СЗ обладает целым рядом преимуществ перед многими другими противовирусными препаратами.
В статье представлен анализ отечественных и зарубежных публикаций, отражающих эпидемиологические особенности гриппа и респираторных вирусных инфекций. Показана эффективность вакцинации против гриппа, проводимой на протяжении последних 17 лет. Представлены
The article analyzes national and foreign publications covering epidemiologic features of influenza and respiratory viral infections. Efficiency of vaccinations against influenza which has been held during the last 17 years, was shown. The results of interferon application, starting from the first years since it was discovered, were presented. The structure of ARVI and influenza morbidity, with allocation of age groups which were mostly involved in the epidemiologic process, was described. The material analysis allows to conclude that, in the period of epidemiologic increase in ARVI morbidity, timely application of recombinant interferon preparations for prevention and treatment allows to reduce influenza and ARVI morbidity, first of all, in organized groups of children and among the contingent under the risk.
За время изучения вирусов гриппа после их выделения от больных людей (1933 г. — вирус гриппа типа А; 1940 г. — вирус гриппа типа В; 1947 г. — вирус гриппа типа С) было установлено, что только вирус гриппа типа А способен к пандемическому распространению. Он вызывает ежегодные сезонные эпидемии и поражает не только людей, но и различных животных [4, 5]. Вирусы гриппа вызывают ежегодные сезонные эпидемии среди населения, а разные его подтипы широко циркулируют среди животных. У вирусов гриппа типа A обнаружено 17 вариантов гемагглютинина (H) и 10 вариантов нейраминидазы (N). Вирусы гриппа типа А подразделяют на подтипы, в соответствии с сочетаниями 2 видов белков вируса (H и N), расположенных на его поверхности.
Этот новый подтип вируса гриппа может за один-два года поразить на нашей планете огромное количество людей любого возраста, поскольку у них нет к нему адаптивного иммунитета. При этом заболевание может протекать тяжелее, возрастет в несколько раз летальность от гриппа и от его осложнений. Такие глобальные эпидемии (пандемии) на разных полушариях начинаются в разные сезоны года [5].
Антигенная изменчивость вируса позволяет ему ускользать от воздействия иммунной системы организма человека. Благодаря этому новый антигенный подтип вируса гриппа избегает сдерживающего эффекта коллективного иммунитета, приобретенного населением в период предыдущих эпидемий. Появление совершенно новых вариантов вируса гриппа типа А происходит нерегулярно. Эти события непредсказуемы и, как правило, могут быть неожиданными [6].
Благодаря значительным и впечатляющим успехам в результате применения программ вакцинопрофилактики в борьбе с инфекционными болезнями удалось добиться многократного снижения заболеваемости, прежде всего инфекциями дыхательных путей.
Вместе с тем ежегодно в мире до 2 млрд человек переносят инфекционные заболевания, из которых около 17 млн умирают. Ежегодно возникают эпидемии сезонного гриппа и респираторных вирусных инфекций, во время которых регистрируют до 5 млн случаев тяжелого гриппа, из которых до 500 000 имеют летальный исход [2].
Во время сезонных подъемов заболеваемости ОРВИ и гриппа в эпидемический процесс вовлекается до 20% населения, половину которых составляют дети в возрасте до 14 лет.
Анализ помесячной динамики заболеваемости ОРВИ и гриппом в Российской Федерации за 2015–2017 гг. показывает, что случаи заболеваний регистрируются круглый год, и только в течение трех месяцев с июня по август отмечается спад заболеваемости. В период эпидемического сезона с октября по апрель выявляют самые высокие показатели заболеваемости, особенно в январе-марте (рис. 1).
Для современной эпидемической ситуации ОРВИ и гриппа характерно распространение заболеваний в основном среди городских жителей, на долю которых приходится около 85% всех заболеваний. При ОРВИ на долю детей в возрасте до 17 лет приходится более 70% всех заболеваний.
Наиболее вовлечены в эпидемический процесс ОРВИ и гриппа дети первых лет жизни и подростки. Причем среди заболевших на детей возрастной группы от 3 до 6 лет, посещающих детские дошкольные организации, приходится более 80% случаев (рис. 2).
На протяжении последнего десятилетия в Российской Федерации ежегодно регистрируют до 35 млн случаев инфекционных (паразитарных) заболеваний, из них более 90% случаев приходится на ОРВИ и грипп, которыми в течение года переболевает до 30% населения Российской Федерации [7]. На долю заболеваний, вызываемых респираторными вирусами и вирусами гриппа, приходится до 40% больничных листов, а экономический ущерб от них составляет до 100 млрд рублей в год, т. е. более 80% совокупного ущерба от инфекционных заболеваний [6, 7].
Для нашей страны, также как и для всех стран мира, значительный социально-экономический ущерб от ОРВИ обусловлен высокими показателями заболеваемости, разнообразием вирусов, вызывающих клинически сходную картину. В настоящее время известно более 200 вирусов, вызывающих сходные заболевания [5, 7].
В Российской Федерации и странах северного полушария в настоящее время ОРВИ, включая грипп, остаются по-прежнему массовыми инфекционными болезнями [6].
По мнению ВОЗ самым эффективным научно обоснованным методом борьбы с гриппом является вакцинопрофилактика. Эффективность вакцинации против гриппа доказана многолетним мировым опытом и может составлять 70–90%. Для достижения эффекта вакцинации необходимо ежегодно охватывать прививками против гриппа не менее 75% людей в каждой группе высокого риска заражения [2, 8].
Результаты вирусологического мониторинга, проводимого ВОЗ, показали растущую резистентность штаммов вирусов к противовирусным препаратам. Наличие нежелательных явлений при их приеме, противопоказаний и ограничений к применению подчеркивает большую значимость вакцинопрофилактики [8].
Ежегодно увеличивающийся охват населения прививками против гриппа в Российской Федерации привел к снижению заболеваемости среди контингентов населения, входящих в группы риска, что подтверждено данными Минздрава России и Роспотребнадзора, среди которых достигается наиболее высокий процент охвата вакцинации. Постоянное планомерное увеличение объема прививок против гриппа среди контингентов, подлежащих вакцинации, позволило достичь в 2017 г. самого высокого охвата прививками за все годы проведения иммунизации (67,3 млн человек, т. е. 46,6% населения).
В 2017 г. по сравнению с 2000 г. на фоне увеличения охвата населения прививками против гриппа в 4,3 раза показатель заболеваемости гриппом в Российской Федерации снизился в 85 раз (с 2973,3 на 100 тыс. нас. до 34,93 на 100 тыс. нас. соответственно) (рис. 3).
Несмотря на резкое снижение заболеваемости гриппом за последние десятилетия в стране, по данным Роспотребнадзора, ежегодно около 30 млн случаев заболеваний ОРВИ, включая грипп, регистрируются во всех субъектах Российской Федерации (табл.).
Только вакцинопрофилактика гриппа не может решать в полной мере проблему ОРВИ, так как у привитых формируются антитела только к штаммам вируса гриппа, входящим в состав вакцины, а в этиологической структуре ОРВИ в настоящее время вирусы гриппа занимают от 5% до 15% (рис. 4). Против других респираторных вирусных заболеваний специфическая профилактика не разработана. Кроме того, не все вакцинируемые отвечают формированием протективного иммунитета, а также вакцины против гриппа не могут использоваться в разгар эпидемии [7].
Поэтому профилактика гриппа и ОРВИ должна быть комплексной, включая проведение неспецифической профилактики с широким применением противовирусных препаратов и лекарственных средств, которые могут оказывать существенное влияние как на предупреждение возникновения заболеваний, так и на благоприятный исход возникшего заболевания.
В 1961 г. английский вирусолог Д. А. Тиррелл впервые исследовал на себе и на своих сотрудниках перспективу интраназального применения ИФН для профилактики респираторных заболеваний и гриппа. Предварительное закапывание в нос ИФН и последующее заражение вирусом Коксаки вызывало лишь легкое недомогание, но не заболевание, в то же время никаких побочных симптомов от применения интерферона у испытуемых не отмечалось [9].
В СССР уже в 1962 г. на добровольцах был получен адъювантный эффект отечественного ИФН при вакцинации, и он был впервые применен для лечения тяжелой формы гриппа, а также как профилактическое средство. В 1964 г. этот препарат с успехом применялся в глазной клинике для лечения вирусного кератоконъюнктивита. В дальнейшем исследования подтвердили безопасность и эффективность лечения вирусных конъюнктивитов с помощью ИФН [9].
Отечественный человеческий лейкоцитарный ИФН для интраназального введения стал первым препаратом, получившим широкое применение в практике здравоохранения Советского Союза.
Во время эпидемии гонконгского гриппа 1968–1969 гг. в СССР была показана высокая эффективность интраназального применения лейкоцитарного ИФН у детей и взрослых.
Однако оказалось, что человеческий лейкоцитарный ИФН имеет недостатки, заключающиеся в низкой степени очистки от вирусных частиц (например, вирусов гепатитов и др.). Эта проблема была решена в середине 80-х гг. прошлого столетия, когда с помощью методов генной инженерии был получен рекомбинантный ИФН, идентичный ИФН человека по аминокислотному составу [9].
После проникновения вируса в организм человека, в большинстве случаев иммунная система реагирует выработкой антител, защитный титр которых появляется на 10–14 день, достигая максимума еще через две недели. Преимущество интерферона заключается в том, что его выработка начинается практически сразу после проникновения вируса в организм, достигая максимума уже на 2-й день. Поэтому ИФН считают первой линией защиты организма от вирусов (рис. 5).
Интерфероны как эндогенные иммуномодуляторы можно отнести к полифункциональным биорегуляторам. Они определяют феномен невосприимчивости клеток к повторному заражению вирусом и обладают комбинированным свойством этиотропного и иммуномодулирующего действия, что позволяет включать их в комплексное лечение гриппа и ОРВИ [8].
В настоящее время наиболее изученными и широко применяемыми являются интерфероны первого типа: ИФН-α и ИФН-β. Действие этих ИФН защищает генетическую информацию клеток хозяина от изменений генома, вызываемого вирусами, и ограничивает пролиферацию поврежденных клеток. При обнаружении патогенных микроорганизмов, вирусов и бактерий макрофаги и дендритные клетки производят ИФН 1-го типа (ИФН-α и ИФН-β). Плазмоцитоидные дендритные клетки вырабатывают ИФН-α, а фибробласты и эпителиальные клетки — ИФН-β. При действии ИФН 1-го типа на дендритные клетки и макрофаги усиливается воздействие на Т- и В-клетки, приводящее к увеличению выработки специфических к вирусу антител.
Интерфероны оказывают действие на все клетки иммунной системы, на продукцию ИФН-α, синтезируемого на первых этапах иммунного ответа, и служат мощными активаторами продукции ИФН-γ, еще задолго до начала его синтеза Т-лимфоцитами [8].
Следует учитывать, что не у всех людей иммунная система способна адекватно реагировать как на внедрение в организм вируса, так и на введение вакцины.
Оптимальная комплексная профилактика ОРВИ, включая грипп, должна проводиться по двум основным направлениям: специфическая иммунопрофилактика и неспецифическая, направленная на усиление иммунорезистентности организма, преимущественно школьников и других возрастных групп риска, с применением в том числе препаратов ИФН.
Одна из основных причин частых и повторных ОРВИ и более тяжелого течения гриппа — несостоятельность местного иммунитета. Учитывая это обстоятельство, неспецифическая профилактика гриппа и ОРВИ в первую очередь должна быть направлена на усиление защитных свойств слизистых оболочек верхних дыхательных путей, что возможно при использовании иммуномодуляторов местного действия. Многочисленные исследования по применению, в рамках профилактических программ, ИФН-α2b, доказывали его эффективное противовирусное действие при всех респираторных инфекциях.
Установлено, что местное применение препаратов рекомбинантного интерферона (капли, мази и др.) оказывается эффективным за счет достижения высоких концентраций активного вещества непосредственно в очаге поражения, при этом развитие аутоиммунных процессов минимизируется [8].
В современных условиях в практике здравоохранения успешно применяют различные противовирусные средства, среди которых достойное место занимают интерферонсодержащие препараты (Гриппферон, Генферон, Реаферон, Виферон, Альфаферон).
Исследования, проводимые на протяжении последних лет, подтвердили, что одним из наиболее эффективных, безопасных и доступных препаратов рекомбинантного интерферона, которые применяются как с профилактической, так и лечебной целью при гриппе и различных ОРВИ, является препарат интерферона — Гриппферон. Данный препарат производится в виде готовых форм — стабильные назальные капли и спрей дозированного применения, а для людей с аллергическим ринитом выпускается мазь назальная с лоратадином.
Гриппферон содержит ИФН-α2b человеческий рекомбинантный не менее 10000 МЕ/мл. Полимерная основа в составе препарата обеспечивает более прочный контакт с клетками слизистой оболочки носа и способствует проникновению интерферона в межклеточное пространство. Препарат не имеет аналогов в мире и разрешен к применению у взрослых и детей с первых дней жизни.
Многолетний опыт изучения Гриппферона подтверждает его противовирусное действие для большинства респираторных вирусов, вызывающих ОРВИ. Особенность Гриппферона — прямое воздействие на первопричину заболевания — препарат предотвращает репродукцию вирусов в зараженном организме. Профилактическое использование препарата в организованных коллективах способствовало снижению заболеваемости гриппом и ОРВИ в 2,5–3,5 раза. Своевременное назначение ИФН-α2b, особенно на ранних стадиях заболевания, приводит к сокращению продолжительности болезни на 30–50%. Преимуществом препарата Гриппферон является то, что он может использоваться не только для профилактики, но и для лечения гриппа и ОРВИ у новорожденных, детей, беременных, взрослых, пожилых людей и пациентов с сопутствующими хроническими инфекциями, вариантами аллергозов, независимо от состояния их иммунного статуса [10–12].
Клинико-лабораторная оценка использования препарата Гриппферон, капли назальные у детей с острой респираторной патологией в лечебных и оздоровительных учреждениях достоверно подтвердила его эффективность — сокращение сроков проявления катарального синдрома (ринит, кашль, гиперемия зева), интоксикации и лихорадки. При использовании препарата в санаториях бронхолегочного профиля было установлено, что снижалась частота повторных ОРВИ [14].
При изучении действия препарата Гриппферон, капли назальные у недоношенных детей в первые 7 недель жизни, имевших контакты с заболевшими ОРВИ, было показано снижение случаев заболевания (в 3,5 раза), а также сокращение как длительности заболевания (в 1,3 раза), так и частоты развития осложнений (в 9,2 раза). Индекс профилактической эффективности составил 9,2 [15].
Проведенное в Ивановском НИИ материнства и детства им. В. Н. Городкова (ФГБУ Ивановский НИИ материнства и детства им. В. Н. Городкова МЗ РФ) изучение эффективности применения препарата Гриппферон у недоношенных детей, родившихся с низкой массой тела и контактировавших с больными ОРВИ, показало, что у 38,5% детей из группы наблюдения заболевание не наступило, тогда как в группе сравнения заболело 96,2% детей. Средняя продолжительность клинического проявления заболевания была почти в два раза короче у детей из группы наблюдения по сравнению с детьми контрольной группы (6,4 против 11,5 дня соответственно). Частота осложнений в группе наблюдения составила 5,7%, тогда как в группе сравнения — у каждого пятого ребенка [16]. Аналогичный результат, показавший эффективность применения препарата Гриппферон, был получен и у детей в возрасте от 3 месяцев до 3 лет, контактировавших с больными ОРВИ.
На кафедре инфекционных болезней РМАНПО (ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования МЗ РФ) была проведена неспецифическая профилактика ОРВИ и гриппа препаратом Гриппферон среди медицинских работников групп риска в период эпидемического сезона 2016–2017 гг. В группу риска вошли все сотрудники кафедры, а также медицинский персонал инфекционного отделения больницы.
Профилактическое применение препарата Гриппферон проведено в два этапа: первый совпал с пиком заболеваемости гриппом в осенне-зимний период, а второй — с началом второй волны эпидемической заболеваемости, что позволило всем наблюдаемым из группы риска избежать заболевания ОРВИ и гриппом.
Таким образом, в рамках неспецифической профилактики гриппа и ОРВИ важное значение имеет своевременное применение, как с профилактической, так и с лечебной целью, препаратов, содержащих интерферон. Широкое использование в практике здравоохранения препаратов на основе рекомбинантных интерферонов, в частности препарата Гриппферон, уже сегодня может привести к значительному снижению заболеваемости населения ОРВИ и гриппом, а также снизить частоту эпидемических вспышек, в первую очередь в организованных коллективах и среди контингентов, относящихся к группам риска.
Литература
Н. Д. Ющук 1 , доктор медицинских наук, профессор, академик РАН
О. С. Хадарцев
ФГБОУ ВО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Использование интерферонов в профилактике и лечении респираторных вирусных инфекций у взрослых и детей/ Н. Д. Ющук, О. С. Хадарцев
В статье описана группа препаратов, рекомендованных МЗ РФ к применению на территории РФ, охарактеризованная как иммуномодуляторы с противовирусной активностью. Представлены их биологические эффекты, дана характеристика препаратов и описана их клиническачя значимость. Акцентируется внимание на преимуществах этой группы препаратов и указаны их недостатки. Подробно описаны результаты фармакотерапевтической эффективности клинически перспективного, ориентированного в педиатрическую практику, метилглюкамина акридонацетата ( циклоферона). Показана его эффектив-ность, изученная в плацебо-контролируемых и сравнительно-контролируемых исследованиях при социально-значимых заболеваниях у детей (ВИЧ-инфекция, вирусные гепатиты, респираторные инфекции, кишечные инфекции). Обсуждаются полученные результаты фармакотерапевтической эффективности препарата на этапе пострегист-рационных исследований.

К иммуномодулирующим средствам И.С.Фрейдлин (1989) относит препараты химической и биологической природы, способные модулировать (угнетать или стимулировать) реакции иммунитета. Они (препараты) воздействуют на иммунокомпетентные клетки, на процессы созревания, миграции, кооперации, а также на взаимодействие этих клеток и их продуктов ( цитокинов) с соответствующими мишенями [21]. Следовательно, лечение той или иной патологии иммунотропными средствами есть иммунотерапия; кроме того, к иммунотерапии необходимо относить методы лечения заболеваний, направленные на нормализацию нарушений в иммунной системе и основанные на использовании иммунотропных средств при заболеваниях, в патогенезе которых имеются нарушения, затрагивающие систему иммунитета[ 22]
По мнению Хаитова Р.М.(2003), основным критерием для назначения иммуномодуляторов является клиническая картина заболевания, проявляющаяся хроническим инфекционно-воспали-тельным процессом, трудно поддающимся адекватному антиинфекционному лечению [23 ].
К лекарственным препаратам с выраженными иммуномодулирующими средствами следует отнести интерфероны и их индукторы поскольку главное фармакологическое свойство этих препаратов - противовирусное, но интерферон как составляющая часть цитокиновой сети организма является иммунорегуляторной молекулой, оказывающей действие на все клетки иммунной системы [ 10, 23].
Таблица 1. Классификация индукторов интерферона [цит.по 10]
Синтетические соединения
Природные соединения
Индукторы интерферонов разных групп
Изучение эффективности индукторов при различных экспериментальных вирусных инфекциях выявило спектр активности этих препаратов и позволило наметить основные пути их дальнейшего клинического применения [ 8,9,14].
Таблица 2. Клиническое значение индукторов интерферона, разрешенных к применению МЗРФ (цит.по 8,14)
Амиксин
Кагоцел
Неовир
Полудан
Герпетический кератит и кератоконъюктивит икератоконьюнктивит
Ридостин
Известно, что одним из свойств индукторов интерферона является формирование в организме стойкой неспецифической резистентности длительный период времени после их введения, который может продолжаться иногда неделями. Сформировавшаяся резистентность не может быть объяснена только действием эндогенного интерферона, синтезированного в ответ на введение индуктора, так как этот интерферон выводится из организма гораздо раньше. Резистентность, по-видимому, является следствием непосредственного влияния индукторов интерферона на клеточный и гуморальный иммунитет, что требует углубленного и детального изучения [9].
Применяемые в клинике индукторы интерферона, индуцируют синтез смеси альфа, бета, гамма- интерферонов в разных пропорциях. Они хорошо сочетаются с другими индукторами, интерферонами разных типов, иммуномодуляторами и химиотерапевтическими средствами. Важно особо подчеркнуть, что комбинированное их введение с другими препаратами часто приводит к синергидному эффекту.
Хотя активность индукторов практически аналогична активности интерферонов, но они ( индукторы) имеют свои "точки приложения" в иммунной системе.
Например, амиксин вызывает медленную продукцию интерферона Т-лимфоцитами, а циклоферон вызывает быструю продукцию интерферона В-лимфоцитами.
Заметно отличаются индукторы и по способности "включать" синтез интерферона в различных органах (мозг, легкие, печень, селезенка и др.), что определяет тактику их использования при различных вариантах органной патологии. Так низкомолекулярные препараты (циклоферон, амиксин) способны преодолевать гематоэнцефаличесий барьер, поэтому активны при вирусных энцефалитах.
У индукторов интерферона есть достоинства, выходящие за рамки только "включения" системы интерферона. Как недавно показано в наших исследованиях, циклоферон вызывает образование ряда провоспалительных и противовоспалительных цитокинов. Это очень важное обстоятельство позволяет рассматривать данный препарат как биорегулятор цитокиновой сети.
Необходимо отметить и некоторые преимущества [9,10] индукторов интерферона:
- в отличие от наиболее широко используемых в настоящее времярекомбинантных интерферонов они не обладают антигенность ;
- синтез ИФН при введении индукторов сбалансирован и контролируется организмом, что предотвращает побочные эффекты, наблюдаемые при передозировке ИФН;
- даже однократное введение индукторов приводит к длительной продукции ИФН в терапевтических дозах, тогда как срок полужизни этих препаратов составляет 20 минут.
Наконец, некоторые индукторы интерферона обладают уникальной способностью "включать" синтез интерферона в определенных популяциях клеток и органов, что в ряде случаев имеет определенные преимущества перед поликлональной стимуляцией иммуноцитов интерферонами.
Эта группа препаратов не лишена и недостатков:
- в отдельных случаях их применение не сопровождается синтезом эндогенного продукта вследствии гипореактивности;
- относительно высокая токсичность амиксина, образование устойчивых комплексов с ДНК;
- невозможность преодоления гематоэнцефалического барьера ларифаном и ридостином, невозможность синтеза эндогенного продукта при пероральном применении;
Основными условиями для медицинского применения индукторов интерферона служат:
- специфическая активность;
- низкая токсичность;
- отсутствие мутагенности, канцерогенности, эмбриотоксичности.
Для правильного использования индукторов интерферона, когда их биологические эффекты выявляются наиболее полно, необходимо знать:
- какие клетки продуцируют интерферон в ответ на введение индуктора,
- какой тип интерферона индуцируется в органах-мишенях [9].
Характеристика индукторов интерферона ( цит.по 8,14)
Амиксин- стимулирует образование альфа/бета и гамма интерферонов, усиливает антителообразование,обладает антибактериальным и противовирусным действием.Пик накопления интерферона в крови (60-120 МЕ/мл) отмечается через 12-18 часов после приема, затем полностью исчезает из кровотока к 72 часам.В лейкоцитах человека индуцированный интерферон не превышает 120 МЕ/мл.
Противопоказания: болезни почек, аллергические заболевания
Ридостин - стимулирует продукцию раннего интерферона альфа/бета типов, отмечается два пика продукции: ранний через 4 часа, поздний - к 48 часам. Уровень интерферона снижается к 72 часам от момента введения препарата.
Наибольшей чувствительностью к препарату обладают лейкоциты больных гриппом, генитальным герпесом.
Наибольшей чувствительностью к препарату обладают лейкоциты больных генитальным герпесом, гриппом, ангиной, ОРВИ.
Арбидол - противовирусный препарат с интерферониндуцирующей активностью,оказывает ингибирующее действие на вирусы гриппа А,В; стимулирует фагоцитоз и антителообразование,Стимулирует гуморальные и клеточные реакции иммунитета.
Клинически наиболее перспективными классами соединений среди ароматических углеводородов оказались низкомолекулярные производные акридина - акридона - препарат циклоферон - метилглюкамина акридонацетат [3 ].
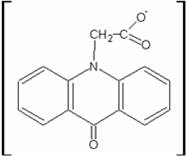
ЦИКЛОФЕРОН
Метилглюкамина акридонацетат
ДОЗА ДЛЯ ДЕТЕЙ -10 мг/кг массы тела.
Клинические исследования эффективности циклоферона проводились у детей и включали плацебо-контролируемые, сравнительно-контро-лируемые исследования. Мы приводим ниже основные результаты, полученные при исследовании эффективности препаратов циклоферона при различной патологии.
Вирусные гепатиты. Исследования проводились у детей, страдающих вирусными хроническими гепатитами с парентеральным механизмом заражения. В результате законченных исследований, установлено, что первичная ремиссия наблюдалась у 47,2%, а стабильная ремиссия у 55,4%, причем полная ремиссия установилась у 44,4% больных, рецидивы заболевания регистрировались лишь в 5,6% случаев.
При ВИЧ-инфекции установлен выраженный лечебный эффект на стадиях IIБ,IIB - IIIА за счет стабилизации иммунного статуса и снижения репликативной активности вируса ( менее 200 копий РНК/ВИЧ в мл).Препарат оказывал наилучшее иммуномодулирующее действие при числе СD4 менее 500, но не ниже 200, при уровне вирусной нагрузке до 30 тысяч копий в 1 мл.
Повышение эффективности лечения гастродуоденальной патологии ( хронический гастродуоденит) с использованием циклоферона увеличилось на 20%. Терапия была направлена на элиминацию H.pylori, а также повышение иммунной защиты организма.
При наблюдении в катамнезе за детьми, страдающими хроническими эрозивными гастродуоденитами, после терапии циклофероном, отмечен рецидив у 6.0% больных, против 17-20.0% больных, получавших стандартный курс терапии [11].
Результаты, вызывающие определенный интерес отмечены при использовании таблетированной лекарственной формы циклоферона в комплексной терапии острых кишечных инфекций [12,19,20].
Микробиологическая санация организма регистрировалась у 90,3% больных получавших циклоферон при дизентерии, сальмонеллезе, а применение циклоферона при сальмонеллезной инфекции обеспечило нормализацию микроэкологии просвета толстой кишки, увеличение индигенной анаэробной и факультативно-анаэробной флоры, элиминацию возбудителя и условно-патогенной микрофлоры, повышение уровня местного секреторного иммуноглобулина А. Включение циклоферона в терапию ротавирусных инфекций у детей приводило к стимуляции синтеза противоротавирусных антител ( до 0.58 отн.ед., против 0.36-0.39 до начала терапии и у больных группы сравнения), обеспечивая быструю санацию кишечника от возбудителя.
В настоящее время проводятся посттрегистрационные исследования эффективности циклоферона при нейроинфекциях.[1] Позитивные результаты получены при серозном менингите. Санация ликвора и длительность стационарного лечения были достоверно короче (11.7 дней, против 18.7), быстрее купировались менингеальные симптомы Цереброастенический синдром возникал гораздо реже, в сравнении с детьми, получавших стандартную терапию. При вирусных энцефалитах отмечали купирование судорожно-коматозного статуса, регресс очаговой неврологической симптоматики, формирование минимального органического дефицита на МРТ - только в случае раннего начала терапии.
При клещевых нейроинфекциях отмечено сокращение лихорадочного периода и сроков санации ликвора, что привело к сокращению длительности пребывания в стационаре, а также к быстрейшему купированию менингеальных симптомов. В катамнезе в течение года не отмечено хронизации процесса.
Анализ клинического течения заболевания при бактериальных менингитах не выявил особой разницы в группе больных, получавших циклоферон и в группе сравнения; Но в группе больных, получавших циклоферон, обратное развитие субдурального выпота происходило на фоне консервативной терапии, а в группе сравнения в половине случаев, пришлось прибегнуть к дренированию субдурального пространства.
Таким образом, фармакотерапевтическая эффективность циклоферона при столь широкой патологии обеспечивается его механизмом действия, включающим противовирусный, интерферониндуцирующий, иммунокорригирующий и противовоспалительный компоненты [17, с.99-109].
Читайте также:

