Газ в цилиндре расширился совершив работу 25 дж внутренняя энергия газа увеличилась на 30
Обновлено: 07.07.2024
3. Как изменяется внутренняя энергия
одноатомного идеального газа при изохорном уменьшении его давления А) уменьшается , Б) увеличивается, В)не изменяется.
4. У
идеальной тепловой машины температура холодильника равна 300 К. Какой
должна быть температура нагревателя , чтобы КПД
машины был равен 40%? А) 800
К, Б) 1200К, В) 600К,
Г) 500К.
5. Один моль идеального газа сжали, совершив работу 500 Дж. Насколько изменилась внутренняя
энергия газа.
6. Постоянной массе неона сообщили
количество теплоты 30кДж теплоты, а он изобарно
расширился. При этом объём газа
увеличился на 0,06 м3 . Каково давление газа?
Сертификат и скидка на обучение каждому участнику

1. Кусок металла удельной теплоёмкостью 500 Дж / (кг • К) нагрели от 20 °С до 80 °С, затратив количество теплоты, равное 75 кДж. Чему равна масса этого куска металла?
2. Относительная влажность воздуха при температуре 100 °С равна 40 %. Определите парциальное давление водяных паров, содержащихся в воздухе.
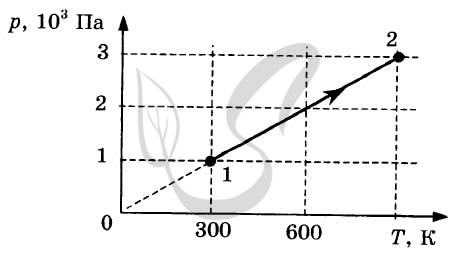
3. Два моля гелия участвуют в процессе 1-2, график которого показан рисунке. Какую работу совершил газ в этом процессе?

4. Относительная влажность воздуха в закрытом сосуде 30 %. Какой станет относительная влажность, если объём сосуда при неизменной температуре уменьшить в 3 раза?
5. На рисунке изображён график зависимости температуры тела от подводимого к нему количества теплоты. Удельная теплоёмкость вещества этого тела равна 500 Дж/(кг • К). Чему равна масса тела?

6. Какую работу совершил газ в процессе, изображённом на pV-диаграмме (см. рисунок)?

7. Находясь в цилиндре двигателя, газ получил от нагревателя количество теплоты, равное 10 кДж. При этом он расширился, совершив работу 15 кДж. На сколько при этом уменьшилась внутренняя энергия газа?
8. Газ в сосуде сжали, совершив работу, равную 30 Дж. Внутренняя энергия газа при этом увеличилась на 25 Дж. Какое количество теплоты отдал газ окружающей среде?
9. Какую работу совершает газ при переходе из состояния 1 в состояние 4 (см. рисунок)?

10. На pV-диаграмме показаны два процесса, проведённые с одним и тем же количеством газообразного неона. Определите отношение работ A2/A1 газа в этих процессах.
11. На VT-диаграмме показан процесс изменения состояния идеального одноатомного газа. Газ отдаёт 30 кДж теплоты. Определите работу внешних сил.
12. Тепловая машина с КПД 40 % за цикл работы отдаёт холодильнику 60 Дж. Какое количество теплоты за цикл машина получает от нагревателя?
13. Какую работу совершает газ при переходе из состояния 1 в состояние 2 (см. рисунок)?

14. Тепловая машина с КПД 60 % за цикл работы получает от нагревателя количество теплоты, равное 100 Дж. Какую полезную работу машина совершает за цикл?
15. На Tp-диаграмме показан процесс изменения состояния идеального одноатомного газа. Масса газа в ходе процесса не меняется. Внутренняя энергия газа уменьшилась на 30 кДж. Определите количество теплоты, отданное газом.

16. На рисунке показано, как менялось давление газа в зависимости от его объёма при переходе из состояния 1 в состояние 2, а затем в состояние 3. Каково отношение работ A12/A23 газа на этих двух отрезках pV-диаграммы?
1. Ответ: 2,5. 2. Ответ: 40. 3. Ответ: 4. 4. Ответ: 90. 5. Ответ: 2.
6. Ответ: 2,5. 7. Ответ: 5. 8. Ответ: 5. 9. Ответ: 2. 10. Ответ: 1.
11. Ответ: 30. 12. Ответ: 100. 13. Ответ: 120. 14. Ответ: 60.

Первый закон, или первое начало термодинамики является частным случаем закона сохранения энергии. Разберемся, как он работает, с помощью решения простых задач. Кстати, у нас есть и примеры решения задач на второе начало термодинамики.
Подписывайтесь на наш телеграм-канал, чтобы не только легко решать задачи, но и узнавать лайфхаки для любых жизненных ситуаций.
Первый закон термодинамики: решение задач
Алгоритм решения задач на первый закон термодинамики ничем не отличается от алгоритма решения любой другой физической задачи. С ним вы можете ознакомиться, открыв нашу универсальную памятку. Также полезно будет держать под рукой формулы, которые часто используются при решении задач.
Задача №1. Применение первого закона термодинамики
Условие
Газ находился в цилиндре с поршнем площадью поперечного сечения 200 см^2. После того, как газ нагрели, сообщив ему количество теплоты в 1,5*10^5 Дж, поршень сдвинулся на расстояние h=30 см. Как изменилась внутренняя энергия газа, если его давление осталось равным 2*10^7 Па.
Решение
Запишем первое начало термодинамики:
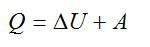
Работу против внешних сил, которую совершил газ, можно найти по формуле из механики:
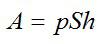
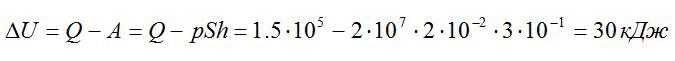
Ответ: 30 кДж.
Задача №2. Применение первого закона термодинамики
Условие
Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое количество теплоты получил или отдал газ в этом процессе?
Решение
Записываем первое начало термодинамики и подставляем значения:
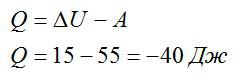
Ответ: в процессе газ отдал 40 Дж теплоты.
Задача №3. Расчет работы, изменения внутренней энергии и количества теплоты
Условие
Кислород нагрели при постоянном давлении p=80 кПа. Объем газа увеличился с 1 до 3 кубических метров. Определить изменение внутренней энергии кислорода, работу, совершенную газом, и количество теплоты, сообщенное ему.
Решение
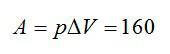
Изменение внутренней энергии равно:
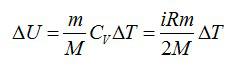
Используем уравнение состояния газа:
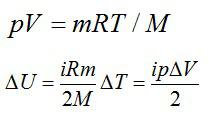
Число степеней свободы i для двухатомной молекулы равно 5.
Согласно первому закону термодинамики, сообщенное газу тепло равно:
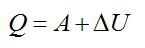
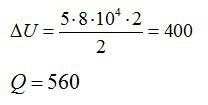
Ответ: А=160 кДж, ∆U=400 кДж, Q=560 кДж.
Задача №4. Изопроцессы
Условие
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Решение
Так как нагревание газа происходит при постоянном объеме, процесс – изохорный. При изохорном процессе:
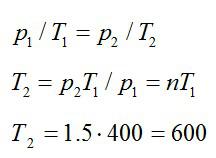
Ответ: 600 К.
Задача №5. Расчет изменения энтропии
Условие
Найти изменение ∆S энтропии при расширении массы m = 6 г гелия от объема V1 = 20 л под давлением р1 = 150 кПа к объему V2 = 60 л под давлением р2 = 100 кПа.
Решение
Изменение энтропии при переходе вещества из состояния 1 в состояние 2:
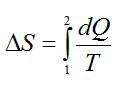
Согласно первому началу термодинамики:
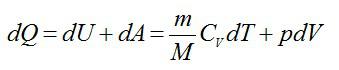
Из уравнения Менделеева-Клапейрона выразим давление:
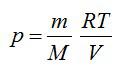
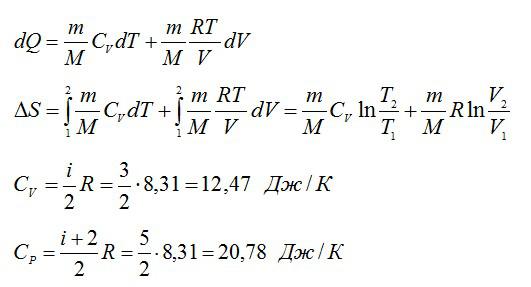
Из уравнения Менделеева-Клапейрона:
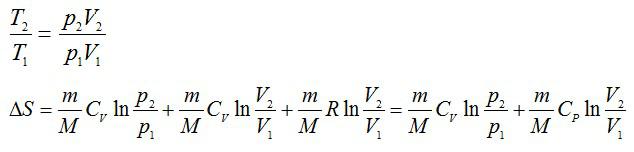
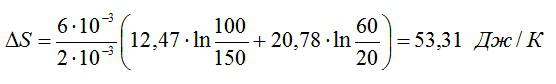
Ответ: ∆S=53,31 Дж/К.
Кстати! Для наших читателей действует скидка 10% на любой вид работы.
Вопрос 1. Приведите пример действия первого закона термодинамики.
Ответ. В качестве примера можно привести газ в сосуде. Если сообщить ему какое-то количество теплоты, оно пойдет на увеличение внутренней энергии газа в сосуде.
Вопрос 2. Сформулируйте первый закон термодинамики.
Ответ. В любой изолированной системе запас энергии остается постоянным.
Вопрос 3. Как еще можно сформулировать первый закон термодинамики?
Ответ. Вот разные формулировки первого закона термодинамики:
- Количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил.
- Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Вопрос 4. Что такое изопроцесс? Какие есть изопроцессы?
Ответ. По определению:
Изопроцесс – это термодинамический процесс, при котором один из параметров системы (давление, объем, температура, энтропия) остается неизменным.
Изопроцесс может быть:
- изотермическим (T=const);
- изобарным (P=const);
- изохорным (V=const);
- Адиабатическим (отсутствует теплообмен с окружающей средой).
Вопрос 5. При каком изопроцессе газ не совершает работу?
Ответ. При изохорном.
Ищете, где почитать теорию по теме, а учебника нет под рукой? Далеко ходить на надо, почитайте наш отдельный материал по первому началу термодинамики. А если при решении заданий понадобится помощь, обращайтесь в профессиональный студенческий сервис.
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Газ в цилиндре расширился совершив работу 150 дж внутренняя энергия
Постоянную массу газа в сосуде сжали, совершив работу 30 Дж. Внутренняя энергия газа при этом увеличилась на 25 Дж. Следовательно, газ
1) получил извне количество теплоты, равное 5 Дж
2) отдал окружающей среде количество теплоты, равное 5 Дж
3) получил извне количество теплоты, равное 55 Дж
4) отдал окружающей среде количество теплоты, равное 55 Дж
Согласно первому началу термодинамики, внутреннюю энергию системы можно изменить, передав системе тепло или совершив над ней работу:
Следовательно, газ получил теплоту
Таким образом, газ отдал окружающей среде количество теплоты, равное 5 Дж.
А ПОЧЕМУ РАБОТУ ОТНИМАЛИ А НЕ ПИБАВЛЯЛИ КАК ПО ФОРМУЛЕ.
На сколько я понял из Вашего вопроса, Вас интересует, почему первое начало термодинамики выписано так, как оно выписано. Прокомментирую.
Существует два способа записи закона сохранения энергии (первого начала) в термодинамике для квазистатических процессов (протекающих достаточно медленно, так что можно считать, что в любой момент времени система находится в состоянии равновесия). Они звучат следующим образом.
1) Внутреннюю энергию системы можно изменить, передав ему тепло или совершив над ним работу:
Обратите внимание, здесь под понимается работа внешних сил над газом: если, например, газ сжимается, то внешние силы совершают над ним положительную работу, ежели он расширяется, то внешние силы совершают отрицательную работу (так как направление действия внешних сил и перемещение стенки сосуда направлены противоположно).
2) Для квазистатических процессов внутреннее давление газа сравнивается с внешним, поэтому работа газа против внешних сил равна по величине и противоположна по знаку работе внешних сил: (при расширении газ совершает положительную работу, при сжатии — отрицательную). Поэтому можно переписать первое начало в следующем виде:
В разных задачах удобно пользоваться разными записями первого начала. Чтобы не путаться в знаках, мой Вам совет: лучше запоминайте не формулы, а тот физический смысл, который за ними кроется (то есть запомните лучше словесные описания).
Алексей, ваши старания достойны уважения, но боюсь в данном случае уже ничего нельзя сделать.
Газ в цилиндре расширился совершив работу 150 дж внутренняя энергия
Постоянную массу газа в сосуде сжали, совершив работу 30 Дж. Внутренняя энергия газа при этом увеличилась на 25 Дж. Следовательно, газ
1) получил извне количество теплоты, равное 5 Дж
2) отдал окружающей среде количество теплоты, равное 5 Дж
3) получил извне количество теплоты, равное 55 Дж
4) отдал окружающей среде количество теплоты, равное 55 Дж
Согласно первому началу термодинамики, внутреннюю энергию системы можно изменить, передав системе тепло или совершив над ней работу:
Следовательно, газ получил теплоту
Таким образом, газ отдал окружающей среде количество теплоты, равное 5 Дж.
А ПОЧЕМУ РАБОТУ ОТНИМАЛИ А НЕ ПИБАВЛЯЛИ КАК ПО ФОРМУЛЕ.
На сколько я понял из Вашего вопроса, Вас интересует, почему первое начало термодинамики выписано так, как оно выписано. Прокомментирую.
Существует два способа записи закона сохранения энергии (первого начала) в термодинамике для квазистатических процессов (протекающих достаточно медленно, так что можно считать, что в любой момент времени система находится в состоянии равновесия). Они звучат следующим образом.
1) Внутреннюю энергию системы можно изменить, передав ему тепло или совершив над ним работу:
Обратите внимание, здесь под понимается работа внешних сил над газом: если, например, газ сжимается, то внешние силы совершают над ним положительную работу, ежели он расширяется, то внешние силы совершают отрицательную работу (так как направление действия внешних сил и перемещение стенки сосуда направлены противоположно).
2) Для квазистатических процессов внутреннее давление газа сравнивается с внешним, поэтому работа газа против внешних сил равна по величине и противоположна по знаку работе внешних сил: (при расширении газ совершает положительную работу, при сжатии — отрицательную). Поэтому можно переписать первое начало в следующем виде:
В разных задачах удобно пользоваться разными записями первого начала. Чтобы не путаться в знаках, мой Вам совет: лучше запоминайте не формулы, а тот физический смысл, который за ними кроется (то есть запомните лучше словесные описания).
Алексей, ваши старания достойны уважения, но боюсь в данном случае уже ничего нельзя сделать.
Газ в цилиндре расширился совершив работу 150 дж внутренняя энергия
Идеальный газ совершил работу 300 Дж и при этом внутренняя энергия газа увеличилась на 300 Дж. Какое количество теплоты отдал или получил газ в этом процессе?
Согласно первому началу термодинамики, тепло, переданное системе, идет на изменение внутренней энергии и совершение работы против внешних сил: Следовательно, газ получил количество теплоты:
Если идеальный газ совершил работу 300 Дж и при этом внутренняя энергия газа уменьшилась на 300 Дж, то газ в этом процессе
4) не отдал и не получил теплоту
Согласно первому началу термодинамики, тепло, переданное системе, идёт на изменение внутренней энергии и совершение работы против внешних сил: Следовательно, газ получил количество теплоты:
Таким образом, газ не отдал и не получил теплоты.
Постоянную массу газа в сосуде сжали, совершив работу 30 Дж. Внутренняя энергия газа при этом увеличилась на 25 Дж. Следовательно, газ
1) получил извне количество теплоты, равное 5 Дж
2) отдал окружающей среде количество теплоты, равное 5 Дж
3) получил извне количество теплоты, равное 55 Дж
4) отдал окружающей среде количество теплоты, равное 55 Дж
Согласно первому началу термодинамики, внутреннюю энергию системы можно изменить, передав системе тепло или совершив над ней работу:
Следовательно, газ получил теплоту
Таким образом, газ отдал окружающей среде количество теплоты, равное 5 Дж.
А ПОЧЕМУ РАБОТУ ОТНИМАЛИ А НЕ ПИБАВЛЯЛИ КАК ПО ФОРМУЛЕ.
На сколько я понял из Вашего вопроса, Вас интересует, почему первое начало термодинамики выписано так, как оно выписано. Прокомментирую.
Существует два способа записи закона сохранения энергии (первого начала) в термодинамике для квазистатических процессов (протекающих достаточно медленно, так что можно считать, что в любой момент времени система находится в состоянии равновесия). Они звучат следующим образом.
1) Внутреннюю энергию системы можно изменить, передав ему тепло или совершив над ним работу:
Обратите внимание, здесь под понимается работа внешних сил над газом: если, например, газ сжимается, то внешние силы совершают над ним положительную работу, ежели он расширяется, то внешние силы совершают отрицательную работу (так как направление действия внешних сил и перемещение стенки сосуда направлены противоположно).
2) Для квазистатических процессов внутреннее давление газа сравнивается с внешним, поэтому работа газа против внешних сил равна по величине и противоположна по знаку работе внешних сил: (при расширении газ совершает положительную работу, при сжатии — отрицательную). Поэтому можно переписать первое начало в следующем виде:
В разных задачах удобно пользоваться разными записями первого начала. Чтобы не путаться в знаках, мой Вам совет: лучше запоминайте не формулы, а тот физический смысл, который за ними кроется (то есть запомните лучше словесные описания).
Алексей, ваши старания достойны уважения, но боюсь в данном случае уже ничего нельзя сделать.
Линия заданий 10, ЕГЭ по физике


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8746.
8778. В процессе эксперимента газ получил от нагревателя количество теплоты, равное 3 кДж. При этом внутренняя энергия газа уменьшилась на 13 кДж. Какую работу совершил газ в этом процессе?
Ответ: ________________ кДж.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8778.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8810.


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8842.


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8874.


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8906.
8938. Газ в цилиндре расширился, совершив работу 150 Дж. Внутренняя энергия газа при этом уменьшилась на 30 Дж. Какое количество теплоты газ получил от окружающих тел?
Ответ: ________________ Дж.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8938.
8970. Какое количество теплоты необходимо для нагревания 100 г свинца от 300 К до 320 К?
Ответ: ________________ Дж.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 8970.
9002. Какое количество теплоты отдает чугунная деталь массой 10 кг при понижении ее температуры на 20 К?
Ответ: ________________ кДж.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 9002.
9034. Относительная влажность воздуха в закрытом сосуде с поршнем равна 40%. Какой станет относительная влажность, если объем сосуда за счет движения поршня при неизменной температуре уменьшить в 3 раза?
Газ в цилиндре расширился совершив работу 150 дж внутренняя энергия
Над одноатомным идеальным газом проводится циклический процесс, показанный на рисунке. На участке 1–2 газ совершает работу Дж. Участок 3–1 — адиабата. Количество теплоты, отданное газом за цикл холодильнику, равно Дж. Количество вещества газа в ходе процесса не меняется. Найдите работу газа на адиабате.
Согласно первому началу термодинамики, переданное газу тепло идет на изменение его внутренней энергии и на совершение работы против внешних сил:
Исследуем все участки цикла по отдельности. На участке 1-2 газ расширяется, совершая положительную работу кроме того его температура растет, а значит, и следовательно, газ получает тепло.
На участке 2-3 объем газа не изменяется, давление, а значит, и температура газа уменьшаются. Поэтому следовательно, газ отдает тепло холодильнику.
Участок 3-1, по условию, представляет собой адиабату, на этом участке газ не обменивается теплом с окружающей средой. Таким образом, все тепло, получаемое газом за цикл, передается ему на участке 1-2, а все тепло, отдаваемое им за цикл, отдается на участке 2-3.
Применим первое начало к участку 1-2: Работе газа на диаграмме соответствует площадь под графиком процесса: Используя уравнение Клаперойна — Менделеева для изменения внутренней энергии на участке 1-2 имеем:
Применим теперь первое начало ко всему процессу в целом. Так как он представляет собой замкнутый цикл, то изменение внутренней энергии за весь процесс равно нулю. Работу газа за цикл можно найти как разность работ на участках 1-2 и 3-1:
I) записаны положения теории и физические законы, закономерности, применение которых необходимо для решения задачи выбранным способом (в данном случае — уравнение Менделеева-Клапейрона, первое начало термодинамики и выражение для работы газа при адиабатном процессе):
Записи, соответствующие одному или обоим пунктам: II и III -представлены не в полном объёме или отсутствуют.
При ПОЛНОМ правильном решении лишние записи, не входящие в решение (возможно, неверные), не отделены от решения (не зачёркнуты, не заключены в скобки, рамку и т. п.).
При ПОЛНОМ решении в необходимых математических преобразованиях или вычислениях допущены ошибки, и (или) преобразования/вычисления не доведены до конца.
В решении отсутствует ОДНА из исходных формул, необходимая для решения задачи (или утверждение, лежащее в основе решения), но присутствуют логически верные преобразования с имеющимися формулами, направленные на решение задачи.
Читайте также:

