Как нежащаяся пантера уложила она голову в изгиб двенадцатиперстной кишки
Обновлено: 05.07.2024
Также стенка дивертикула может состоят из тех же слоев, что и стенка органа, или быть без мышечного слоя. Соответственно их подразделяют на истинные и псевдодивертикулы.
Дивертикулы в желудочно-кишечном тракте могут располагаться на всем протяжении, что вызывает различные клинические проявления и осложнения, в зависимости от уровня.
В пищеводе дивертикулы встречаются на всем протяжении. В зависимости от расположения они и классифицируются:
1. Глоточно-пищеводные
2. Фарингоэзофагеальные
3. Эпибронхиальные (бифуркационные, среднепищеводные)
4. Наддиафрагмальные [1]
В зависимости от причин возникновения они делятся:
1. Пульсионные (из-за нарушений перестальтики)
2. Тракционные (в связи с возникновением рубцовых изменений при воспалении)
Причинами развития дивертикула пищевода могут быть:
1. Рефлюкс–эзофагиты
2. Инфекционное поражение (туберкулез, грибковая инфекция)
3. Травма
4. Воспалительные процессы в близлежащих органах (медиастенит) [2]
Симптоматика зависит от локализации выпячивания
Наиболее ярко проявляется дивертикул Ценкера (в области глоточно-пищеводного перехода). Развивается дисфагия (нарушение прохождение пищи, тошнота), появляется неприятный запах изо рта, изменение тембра голоса. При расположениях дивертикула в нижней трети пищевода могут быть боли в области сердца, бронхоспазм, одышка.
Дивертикулы пищевода могут сопровождаться медиастенитом (воспалением средостения), флегмоной шеи, формированием свища и сепсисом, эрозированием слизистой и развитием рака пищевода.
Основным методом диагностики является рентгенологическое исследование (осмотр в рентген аппарате после приема контрастного вещества). Дополнительным методом является эзофагоскопия эндоскопическая ( осмотр в просвете зондом с видеокамерой), которая позволит осмотреть состояние слизистой у дивертикула, однако проводить его нужно крайне осторожно, в связи с опасностью перфорации.
Излечить дивертикул можно лишь хирургически (удалив его).
При опасности операций – тяжелые сопутствующие заболевания - возможна консервативная терапия, заключающаяся в диете, приеме противовоспалительных препаратов (обволакивающих слизистую пищевода, понижающих секрецию желудка).
В современной медицине используют лапароскопическую технику удаления дивертикулов пищевода – торакоскопию, когда на теле выполняется лишь несколько небольших разрезов, а само удаление проходит внутри грудной полости. Это позволяет сократить сроки реабилитации пациентов.
Дивертикулы толстого кишечника
В толстом кишечнике дивертикулы чаще встречаются в левом отделе кишечника (сигмовидной кишке).
Возникновение их связано с изменением эластичности стенки кишки, повышенным содержанием в рационе человека рафинированной пищи и минимизации пищевых волокон. При повышении внутрипросветного давления в кишке, слизистая пролабирует через слабые места (обычно это место выхождения сосуда в стенке кишечника). Дивертикулы реже встречаются у вегетарианцев и чаще у людей с проявлением дисплазии (растяжимости) соединительной ткани (особенно такие заболевания, как поликистоз почек, синдром Марфана).[3]
Выделяют разные состояния, связанные с дивертикулами толстой кишки.
А. Дивертикулез ободочной кишки (то есть наличие дивертикулов без клинических проявлений)
Б. Клинически выраженный дивертикулез (наличие дивертикулов , отсутствие признаков воспаления или кровотечения)
В. Дивертикулярная болезнь (наличие дивертикулов, а также наличие симптоматики, которые могут быть связаны с ними – кровотечение, воспаление) [4]
Дивертикулярная болезнь толстого кишечника проявляется лишь при воспалении в стенке дивертикула. Клинически это вздутие живота, боли в нем, нарушение стула, в том числе, диарейный синдром.[8]
Осложнения
При ярко выраженном воспалении возникает кровотечение, в связи с интимным расположением сосуда в стенке дивертикула, кишечное кровотечение порой лечиться хирургически.[7]
Возможно возникновение паракишечного инфильтрата, а порой и абсцесса. При перфорации дивертикула возникает каловый перитонит.[9,10]
Основным диагностическим методом дивертикулярной болезни толстой кишки является фиброколоносокопия – внутрипросветный осмотр кишки, а также осмотр состояния слизистой у дивертикулов. Дополнительно может применяться ирригоскопия (осмотр на рентгенаппарате, после введения контрастного вещества в клизме). Также с целью уточнения применяются такие методы, как виртуальная фиброколоноскопия (когда осмотр проходит в аппарате МРТ, а компьютерная программа сама создает картинку кишечника в просвете).
Лечение
Хирургическое лечение дивертикулярной болезни применяется лишь при осложнениях.
Пациентам при наличии дивертикулов в толстой кишке назначается высокошлаковая диета с дополнительным введением пищевых волокон.
При индивидуальных особенностях и клинических проявлениях в виде болей, спазмов в животе применяют препараты месалазина, систематически, курсами.[11] Хороший эффект дает применение пробиотиков, спазмолитиков и прокинетиков (препаратов, снижающих спазм в кишечнике, регулирующих синхронную работу мышечной стенки кишки).
Регулярное опорожнение кишечника и соблюдение диеты минимализирует возможность возникновения дивертикулов кишечника. Проведенные клинические исследования показали снижение заболеваемостью дивертикулярной болезнью при их приеме. Волокна ускоряют транзит (продвижение каловых масс по кишечнику), уменьшают запоры, тем самым способствуют снижению напряжения на стенку кишечника.
- Целлюлоза - неразветвленный полимер глюкозы, содержащий до 10 тысяч мономеров.
- Гемицеллюлоза состоит из пентозных и гексозных остатков, с которыми связаны остатки арабинозы, глюкуроновой кислоты и ее метилового эфира.
- Гумми (камеди) производная глюкуроновой и галактуроновой кислот, к которым присоединены соли магния и кальция, арабиноза, манноза, ксилоза.
- Пектин – полимеры молекулами галактуроновых и гулуроновых кислот. Пектиновые вещества – это группа высокомолекулярных соединений, входящих в состав клеточных стенок и межуточного вещества высших растений
- Лигнин – это неуглеводное вещество. Минимальное содержание в незрелых фруктах и овощах.
- Альгинаты – соли альгиновых кислот, основное содержание в водорослях.
- Слизи - разветвленные сульфатированные арабиноксиланы.
Дивертикулы тонкой кишки
Распространенность дивертикулов тонкой кишки населения планеты составляет 0,5–2,3%[5].
Дивертикулы двенадцатиперстной кишки (ДПК)
Дивертикулы двенадцатиперстной кишке чаще приобретенные, возникают у лиц старше 50 лет. При воспалении вызывают боли в правом подреберье, иррадиирующими в левую лопатку.
Данный дивертикул находится в непосредственной близости к фатеровому сосочку в ДПК, вирсунговому протоку. При воспалении и отеке может вызвать механическую желтуху, острый панкреатит, холангит.
Дивертикулы тощей и подвздошной кишки.
Обычно являются случайной находкой при рентгенологических исследования, не дают клинической симптоматики.
Первый дивертикул описан в 1906 году. Это локальное мешковидное выпячивание стенки подвздошной кишки, образованное из-за неполного заращения желточного протока, участвующего в питании зародыша, располагающийся в 10 -100 см от илеоцекального узла, размерами от 5 до 50 см. Порой в нем располагаются клетки слизистой желудка, а также ткань поджелудочной железы ( до 50 % случаев), что может являться причиной кровотечений и опухолей[6].
В диагностике большое значение придается видеокапсульной эндоскопии, позволяющей четко определить изменение слизистой в том числе. Методом выбора может служить компьютерная томография. Лапароскопия также используется для диагностики, при этом нередко – одновременно с его удалением.
Дивертикулит, непроходимость, перфорация и кровотечения – развиваются в 10–30% случаев. Механическая кишечная непроходимость может быть вызвана инородным телом, инвагинацией, растянутыми дивертикулами при воспалительном процессе, спайками, стриктурами, образовавшимися вследствие прошлых воспалений . При прогрессировании воспалительного процесса возможны кровотечение, непроходимость, перфорация дивертикула. В этом случае может развиться перитонит.
Тактика зависит от клинических проявлений.
Кровотечение. Кровотечение может возникнуть при любом расположении дивертикула. Кровь, выделяемой крови чаще темно-бордовый (в связи с высоким расположением источника кровотечения – тонкая кишка). Для диагностики кишечного кровотечения применяют эндоскопические методы (лапароскопия, видеокапсульная эндоскопия) и ангиографию (введение контрастного вещества в кровь и осмотр в рентгенаппарате сосудов, питающих данный участок тонкой кишки). Лечение чаще оперативное (удаление пораженного участка тонкой кишки или попытка ушития кровеносного сосуда).
Кишечная непроходимость. Чаще осложнение такое встречается у маленьких дитей, при завороте дивертикула. Кишечная непроходимость может быть вызвана энтеролитами (кишечными каловыми камнями), спайками, возникающими от воспаления дивертикула (дивертикулита). При данном осложнении также проводится хирургическое лечение (удаление дивертикула и, возможно, резекции части кишки).
Дивертикулит. Нередко энтеролиты (плотные каловые камни) служат причиной воспалительных изменений в дивертикуле, вызывают ущемление или застой в сосудах, питающих стенку кишечника. В этом случае лечение может ограничиться антибиотикотерапией, противовоспалительным лечением, при отсутствии эффекта и перфорации дивертикула и формировании абсцесса лечение оперативное.
Абсцесс и перитонит. При прогрессировании воспалительного процесса в дивертикуле развивается абсцесс, перфорация которого приводит к перитониту. Лечение оперативное: выполняется резекция участка кишки с воспаленным дивертикулом с последующей антибиотикотерапией.
Механическая желтуха и панкреатит. Эти осложнения развиваются при воспалении парафатерального дивертикула. В этом случае назначается антибиотикотерапия, а при отсутствии эффекта –хирургическое лечение.
На сегодняшний день четко определить распространенность хронической непроходимости двенадцатиперстной кишки (ДПК), по данным литературы, крайне затруднительно, несмотря на то, что в последние десятилетия ряд ее причин, таких как синдром верхней мезентериальной артерии, активно обсуждают и анализируют в мировой хирургической печати [1—5]. При этом хроническое нарушение проходимости ДПК чаще встречается у женщин молодого возраста и имеет затяжное медленно прогрессирующее течение [2]. Острое начало заболевания регистрируется крайне редко и лишь при обильном переедании, выступающем в роли триггерного фактора [6].
Зачастую хроническое нарушение проходимости ДПК следует рассматривать как гастроэнтерологическую проблему, требующую широкого спектра консервативной лекарственной терапии и применения физиотерапевтических методик [1]. Лишь в случае суб- или декомпенсации течения заболевания хирургическая компонента лечения является ключевой в судьбе пациента [2, 7].
Вашему вниманию предлагаем редкий вариант хронической непроходимости ДПК у молодой пациентки с успешным применением хирургического лечения.
Больная Г., 21 года, госпитализирована в ГБУЗ ГКБ им. В.В. Вересаева 21.02.17 с жалобами на абдоминальную боль, общую слабость, чувство тяжести в эпи- и мезогастрии, рвоту застойным содержимым. При поступлении подозревали эпигастральную фазу острого аппендицита, кишечную непроходимость. В анамнезе в младенчестве (на первой неделе жизни) лапаротомия по поводу желудочно-дуоденальной мембранозной непроходимости, выполнена операция в объеме гастродуоденотомии, фенестрации мембраны.

Рис. 1. Обзорные рентгенограммы органов брюшной полости. а — уровень жидкости в проекции поперечной ободочной кишки; б — проведение пробы Шварца: желудок резко расширен до уровня гребня подвздошных костей, уровень жидкости в проекции антрального отдела желудка, пассаж бария по петлям тонкой кишки сохранен; в — продолжение пассажа бариевой взвеси, уменьшение объема уровня жидкости. Бариевая взвесь в начальных отделах слепой кишки; г — отрицательная рентгенологическая картина. Нарастание уровней жидкости при сохраненном пассаже бария по тонкой кишке и в правых отделах ободочной кишки.
Госпитализирована в хирургическое отделение, где начата консервативная инфузионная дезинтоксикационная, противовоспалительная терапия, назогастральная декомпрессия зондом. Принимая во внимание схваткообразный характер боли и оперативное вмешательство в анамнезе, для исключения спаечного генеза кишечной непроходимости провели пробу Шварца с мониторингом пассажа бариевой взвеси. В динамике лечения отмечены поступление по назогастральному зонду до 1300 мл застойного содержимого, а также застой бариевой взвеси в расширенном желудке (нижний край расположен на уровне гребня подвздошных костей) при сохраненном замедленном пассаже в правые отделы ободочной кишки (см. рис. 1, б, в). На утро 22.02 отмечены усиление боли схваткообразного характера, появление сомнительной перитонеальной симптоматики в мезогастрии, отрицательная рентгенологическая картина (см. рис. 1, г). Принято решение об оперативном лечении, получено согласие.
Операция начата с диагностической лапароскопии, методом открытой лапароскопии установлен оптический троакар. В брюшной полости на доступных осмотру отделах выпота нет, петли кишечника неоднородно расширены до 3 см, с вялой перистальтикой, отмечается массивный спаечный процесс с выраженными висцеропариетальными и висцеро-висцеральными сращениями от пленчатых до массивных фиброзных тяжей. Принято решение о конверсии на операцию из срединного доступа. После лапаротомии в рану выведен резко увеличенный, атоничный желудок, занимающий весь верхний отдел брюшной полости. После мобилизации спаечных пленчатых сращений обнаружили дилатированную до 10—12 см двенадцатиперстную кишку (рис. 2, а), в проекции пилородуоденального перехода определялся рубец после гастродуоденотомии (в анамнезе). Двенадцатиперстная кишка с активной пропульсивной перистальтикой. После парциального адгезиолизиса выполнен прием Губарева с ревизией дуоденоеюнального перехода, последний фиксирован высоко с острым углом отхождения первой порции тощей кишки, а также массивными висцеро-висцеральными сращениями тонкой кишки на всем протяжении, но с максимумом в проекции первых 20—30 см от связки Трейтца (см. рис. 2, б). С техническими трудностями выполнена раздельная назогастральная и назоэнтеральная интубация, при этом на зонде произведены операция Стронга (рассечение связки Трейтца), а также парциальный прицельный адгезиолизис. Зонд Miller—Abbott заведен до подвздошной кишки, при этом на всем протяжении двустволки разделены с укладкой на зонде. Брюшная полость дренирована тремя силиконовыми дренажами по латеральным каналам и справа в малый таз, выведенными через контрапертуры с ушиванием послеоперационной раны. Назогастральный и назоинтестинальный зонды удалены на 4-е сутки после операции, дренаж из правого латерального канала — на 5-е сутки.

Рис. 2. Интраоперационные фотографии. а — резко расширенные желудок и ДПК; б — расширенные желудок и ДПК; висцеро-висцеральные сращения в области связки Трейтца (указаны стрелками).
Послеоперационный период на 6-е сутки осложнился появлением кишечного отделяемого по страховочному дренажу слева, что потребовало релапаротомии с ушиванием перфорации острой язвы тонкой кишки. При этом отмечен выраженный адгезивный спаечный процесс с отграничением зоны перфорации в проекции левой подвздошной ямки. В дальнейшем гладкое течение послеоперационного периода. Самостоятельный стул регулярный с 4-х суток после операции. Страховочные дренажи удалены на 2-е сутки после релапаротомии. Пациентка выписана в удовлетворительном состоянии. Швы сняты на этапе амбулаторного долечивания, заживление per prima.
На амбулаторном этапе лечения получала прокинетическую терапию — мотилиум по 1 таблетке 3 раза в сутки в течение 3 нед. По данным электроэнтерографии и последующей резонансной стимуляции [8] отметили прирост вольтажа перистальтической активности всех отделов пищеварительного тракта с синхронизацией навязанных ритмов (рис. 3, а, б). Осмотрена через 1 мес после операции, здорова, прибавка в массе 1,5 кг, жалоб нет. Данные электроэнтерографии (см. риc. 3, в) свидетельствуют о сохранении удовлетворительного вольтажа перистальтической активности. Появился аппетит, улучшилось настроение.

Рис 3. Результаты электроэнтерографии больной Г. а — перистальтическая активность возбудимых структур пищеварительного тракта до применения резонансной стимуляции; б — на фоне резонансной стимуляции перистальтической активности удалось добиться частичной синхронизации перистальтических комплексов; в — сохранение собственной перистальтической активности после лечения.
Синдром хронической непроходимости ДПК — это клинический симптомокомплекс, обусловленный нарушением моторной и эвакуаторной деятельности двенадцатиперстной кишки различной этиологии (органической или функциональной природы), приводящий к задержке (стазу) содержимого ДПК.
Хроническая дуоденальная непроходимость является многофакторным состоянием, при котором этиологическую причину следует систематизировать как механическую обструкцию (органическая хроническая непроходимость ДПК) и функциональную группу состояний (первичных и вторичных). При этом среди органических факторов на первом месте следует рассматривать так называемую артериомезентериальную компрессию (синдром Уилки, синдром верхней мезентереальной артерии), незавершенный поворот средней кишки, кольцевидную поджелудочную железу, а также высокую фиксацию дуоденоеюнального перехода и спаечную болезнь брюшины со сращением проксимальной петли тощей кишки с восходящей частью ДПК [1, 2, 4, 9, 10]. На основании клинических и инструментальных признаков следует выделять компенсированный, суб- и декомпенсированный варианты обструкции, при этом участок непроходимости чаще всего локализуется в анатомических отделах ДПК, находящихся забрюшинно, а в проекции восходящего отдела (4 порция) лишь у 8% пациентов [1].
История учения о дуоденостазе как медицинской проблеме корнями уходит глубоко в века, при этом в первом подробном описании в литературе F. Boernerus (1752 г.) ссылается на более ранние работы (I век до н.э.), описывающие характерные изменения анатомии, выявленные при секционном исследовании [2, 11]. Безусловно, учение о хронической непроходимости ДПК переживало свой ренессанс с конца XIX века, когда появились доскональные и фундаментальные знания анатомии, физиологии пищеварения, а также отмечался расцвет хирургии верхних отделов желудочно-кишечного тракта. Справедливости ради следует указать на работу J. Anderson [12] как своеобразную отправную точку в учении о хронической непроходимости ДПК, механизмах ее развития, а также попытках консервативной коррекции состояния. В то время наблюдались в основном лишь единичные примеры и повествования о клинических случаях и секционных находках, а полноценные серии наблюдений появились лишь в начале XX века [11]. В одном из первых подобных систематизированных обзоров по проблеме указывалось на доступные в литературе к 1908 г. 217 наблюдений с попыткой анализа причин и механизмов формирования непроходимости и классификацией состояния [13]. В работе D. Wilkie [10] проводится детальное описание клинической картины, а также морфологического субстрата одного из подвидов обструкции ДПК — синдрома верхней брыжеечной артерии, названного в дальнейшем по имени автора. В последующем отмечается рост интереса к изучаемой проблеме в мировой литературе.
Первое упоминание проблемы непроходимости ДПК в русскоязычной печати относится к концу XIX века, а целенаправленные операции выполняли с начала XX столетия, но лишь с середины 20—30-х годов в отечественной литературе отмечается повышенный интерес к этой проблеме [2]. Наибольшее число публикаций и освещение проблемы непроходимости ДПК отмечается во второй половине XX века, когда увидели свет фундаментальные монографии Я.Д. Витебского [14], Ю.А. Нестеренко [15].
В наше время за счет возможности детальной визуализации (МСКТ, МРТ), а также применения видеолапароскопии появляются многочисленные клинические наблюдения и обзоры, в том числе с возможностью применения малоинвазивных технологий для коррекции этого состояния [3, 16—18].
Как правило, у пациентов с хронической непроходимостью ДПК бывают астеническая конституция, плаксивость, состояние тревоги. Обычно таким пациентам длительное время проводят лечение по поводу различных предполагаемых заболеваний, при этом болезнь медленно прогрессирует, постепенно приводя к выраженной астенизации и истощению [15].
Одним из наиболее информативных методов инструментального обследования нужно признать рентгенологическое исследование с серией обзорных и прицельных снимков. При этом рентгенологически различают 3 стадии, а при необходимости более детального определения причины обструкции выполняют релаксационную дуоденографию [1] или МСКТ брюшной полости [16]. Как дополнение к лучевым технологиям следует рассматривать внутрипросветную эндоскопию [1, 7], а также pH-метрию для количественной оценки рефлюкса и поэтажную манометрию по Я.Б. Витебскому [14].
Лечение при заболевании в стадии суб- и декомпенсации сугубо хирургическое, однако важное значение отводится использованию физиотерапевтических методик, в том числе транскутанной стимуляции моторики желудка и ДПК с помощью электроимпульсной терапии синусоидально модулированными токами, резонансной стимуляции и т. д., а также медикаментозной терапии прокинетиками [1, 5].
Диапазон хирургических вмешательств колеблется от дуоденоеюностомии или адгезиолизиса с низведением и распрямлением дуоденоеюнального изгиба до транспозиции ДПК или формирования многочисленных соустий как традиционным способом, так и с применением малоинвазивных технологий [1, 5, 7, 9, 17, 19].
У пациентов с хронической непроходимостью ДПК, обусловленной высокой фиксацией дуоденоеюнального перехода и спаечным процессом зоны интереса, а также при гиперкинетическом варианте мегадуоденума производятся мобилизация и низведение дуоденоеюнального изгиба — так называемая операция Стронга [1, 20] с возможным дополнением последней в виде продольной двусторонней миотомии луковицы и нисходящего отдела ДПК [1].
При реабилитации большинства подобных больных возможно применение по принципам fast-track раннего перорального кормления, при этом отмечается быстрое восстановление перистальтики и зачастую не требуется прокинетической терапии в послеоперационном периоде [5, 9].
Как правило, летальность после оперативного лечения хронической дуоденальной непроходимости ДПК невысокая, а отдаленные результаты позволяют с оптимизмом смотреть на качество оказания помощи.
Таким образом, несмотря на бурный скачок хирургии в последние годы, часто применяют и традиционные вмешательства, особенно при срочных вмешательствах. Учитывая редкость таких клинических наблюдений, необходимо иметь в виду различные сценарии развития процесса, тем более у молодых пациентов с отягощенным оперативным анамнезом. Применение парциального адгезиолизиса с низведением дуоденоеюнального перехода является операцией выбора у пациентов с описанным выше типом хронической непроходимости двенадцатиперстной кишки, а использование прокинетической терапии и транскутанной электростимуляции перистальтической активности кишечника позволяет достигать не только улучшения состояния, но и выздоровления исходно тяжелобольных.

Резекция (лат.resectio – обрезывание, срезывание) — операция удаления части органа или анатомического образования.
Резекция кишки выполняется с целью удаления пораженного ее участка в пределах здоровых тканей. После удаления пораженного участка кишки остаются два просвета кишки. Один приводящий, другой отводящий. Непрерывность кишечной трубки восстанавливается путем наложениея анастомоза. При этом формирование кишечного шва производится либо с помощью специальных сшивающих аппаратов, либо накладывается ручной кишечный шов.
В зависимости от характера поражения кишки, локализации и размеров очага поражения, резекция может быть секторальной, экономной, расширенной. Кроме того, отдельно выделяют резекции толстой и прямой кишки при опухолевых заболеваниях.
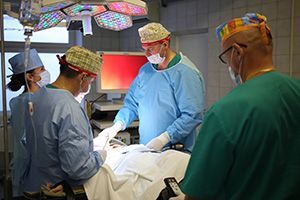
- Стоимость: 130 000 - 280 000 руб.
- Продолжительность: 1-2 часа
- Госпитализация: 5-7 дней в стационаре
Анатомия кишки
Как анатомическое образование кишечная трубка начинается с двенадцатиперстной кишки, которая расположена забрюшинно, т.е. покрыта париетальной брюшиной (тонкой пленкой, выстилающей изнутри брюшную стенку). Таким образом, она изолирована от свободной брюшной полости и плотно фиксирована в забрюшинном пространстве. Двенадцатиперстная кишка имеет подковообразную форму, конечная ее часть переходит в тощую кишку. При этом место перехода подтянуто связкой Трейца и образует острый угол, который в норме предотвращает обратный заброс кишечного содержимого в двенадцатиперстную кишку. От связки Трейца начинается тонкая кишка. Она находится внутрибрюшинно, имеет достаточно длинную брыжейку, которая обеспечивает значительную ее подвижность. Длина тонкой кишки варьирует от трех до семи метров. Она разделена на два отдела: тощую и подвздошую кишку. Граница условна, поскольку не имеет анатомических ориентиров. Подвздошная кишка переходит в толстую кишку.
Кровоснабжение тонкой кишки происходит из верхней брыжеечной артерии, отходящей от аорты. От нее в брыжейке проходят тонкокишечные артерии (от 12 до 16 ветвей), которые делятся на тощекишечные и подвздошнокишечные ветви. Анастомозируя между собой они образуют аркады первого, второго и выше порядков, калибр которых уменьшается по мере приближения к кишке. У самой стенки они образуют непрерывный сосуд (краевой), от которого к стенке кишки отходят прямые короткие сосуды.
Венозный отток осуществляется обратным порядком по прямым венам, которые образуют широкие аркады, из них собираются вены тощей и подвздошной кишок. Все вены, сливаясь, образуют верхнюю брыжеечную вену. Последняя идет параллельно одноименной артерии, она собирает кровь от тонкой, слепой, восходящей ободочной, части поперечно-ободочной кишки.
Таким образом, благодаря аркадности обеспечивается достаточно богатое кровоснабжение тонкой кишки, что создает благоприятные условия для резекции и наложения анастомоза.
Лимфатическая система тоже развита широко. Основные коллекторы лимфоузлов располагаются в три ряда. Первый ряд лимфоузлов располагается вдоль брыжеечного края кишки, второй проходит на уровне сосудистых аркад, третий — по ходу главных ветвей верхней брыжеечной артерии. Однако некоторые лимфатические сосуды проходят в грудной лимфатический проток, минуя перечисленные заслоны из лимфатических узлов. Этим объясняется случаи быстрого метастазирования злокачественного процесса.
Толстая кишка является конечным отделом пищеварительного тракта и делится на отделы: слепую, ободочную и прямую кишку.
Толстая кишка кровоснабжается из систем верхней и нижней брыжеечных артерий, отходящих от аорты. Правая половина кровоснабжается от верхней брыжеечной артерии. Он нее к соответствующим оделам кишки (слепая, восходящая и часть поперечно-ободочной кишки) отходят подвздошно-толстокишечная, правая и средняя толстокишечные артерии. Левая половина ободочной кишки, сигмовидная и частично прямая кишка кровоснабжаются соответственно по отделам левой толстокишечной, сигмовидными и верхней прямокишечной артериями, отходящими от нижней брыжеечной артерии.
Венозная и лимфатическая системы сопровождают артериальную, причем особенность состоит в том, что первый лимфатический барьер находится в непосредственной близости от кишки в периферических сосудистых ветвлениях, а второй и третий – вокруг магистральных сосудов.
Сохранность Риолановой дуги очень важна при выполнении резекции различных отделов кишки.
Прямая кишка располагается в малом тазу, прилежит к крестцу, полностью находится забрюшинно. Длина кишки около 15 см. По форме имеет форму ампулы, имеет три изгиба. Согласно этим особенностям различают верхнеампулярный, среднеампулярный и нижнеампулярный отделы. Это разделение важно при выборе уровня резекции прямой кишки. Заканчивается прямая кишка заднепроходным каналом. Сложный сфинктерный аппарат, состоящий из наружного и внутренних сфинктеров, обеспечивает замыкательную функцию анального канала.
Прямая кишка имеет три основных источника кровоснабжения: верхнюю прямокишечную артерию (продолжение нижней брыжеечной артерии) и парные средние и нижние прямокишечные артерии, входящие в кровеносный бассейн внутренней подвздошной артерии.
Венозный отток осуществляется по одноименным венам. При этом они образуют в стенке кишки венозные сплетения.
Отток лимфы от верхнего отдела ампулы происходит по верхней прямокишечной артерии в лимфоузлы нижней брыжеечной артерии, что следует учитывать при выполнении резекции. От среднего отдела кишки лимфа отходит к лимфоузлам подвздошных артерий. От нижнего отдела — к паховым лимфоузлам. Кроме того, в процессе задействованы лимфоузлы брыжейки прямой кишки, т.н. мезоректума. Через них могут распространяться метастазы вдоль кишки.
Это очень важные знания, поскольку их использование на практике позволяет выполнять расширенные резекции с соблюдением принципов онкологической безопасности, о чем будет сказано ниже.
Показания к резекции тонкой кишки
В экстренной хирургии показаниями к резекции тонкой кишки являются следующие состояния:
В плановом порядке резекция кишки бывает показана при наличии новообразований тонкой кишки.
Доброкачественные образования в зависимости от размера могут быть удалены либо с использованием секторальной, либо экономной резекции с соответствующим восстановлении проходимости. При злокачественных новообразованиях производится расширенная резекция с клиновидной резекцией брыжейки и удалением проходящего в ней артериально-лимфатического комплекса, связанного с пораженным участком кишки.
Показания к резекции толстой кишки
Резекция по экстренным показаниям.
Нижний отдел кишечной трубки, к которому относится толстая и прямая кишка, имееют ряд особенностей. Прежде всего это сегментарное кровоснабжение, не такое обильное, как у тонкой кишки, а также очень агрессивная кишечная флора просвета нижних отделов. В этих условиях экстренная резекция не всегда может быть закончена наложением анастомоза. Слишком велика опасность несостоятельности. В подавляющем большинстве случаев производится так называемая обструктивная резекция кишки, при которой после удаления участка кишки с очагом поражения анастомоз не накладывается. Нижний (отводящий) коней кишки ушивается наглухо. Верхний (приводящий) выводится в виде колостомы на переднюю брюшную стенку.
Операция безопасна тем, что нет слабого звена — "анастомоза". Она выполняется при осложненных заболеваниях толстой кишки: разрывах дивертикула с образованием воспалительного инфильтрата или абсцесса, массивных ранениях кишки, острой обструктивной непроходимости, других ситуациях, сопровождающихся воспалением и некрозом стенки кишки.
Восстановление целостности кишки, наложение анастомоза производят в плановом порядке не ранее чем через четыре и более меяцев после обструктивной резекции.
Плановые операции на толстой кишке.
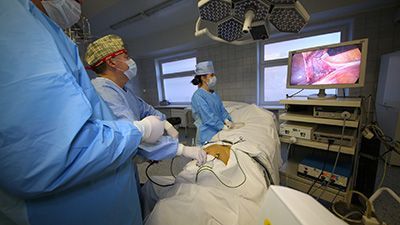
Следует отметить, что плановая хирургия толстой и прямой кишки является одним из основных направлений хирургической деятельности нашего Центра. Плановые операции выполняются в основном по поводу:
- новобразований кишки (при доброкачественных и злокачественных опухолях);
- дивертикулярной болезни;
- долихосигмы.
При доброкачественных заболеваниях пораженные участки удаляются методом экономной резекции с анастомозом "конец в конец".
Рак толстой кишки требует более серьезных расширенных резекций. Смысл операции состоит не только в удалении раковой опухоли, но и в профилактике рецидива заболевания в отдаленные сроки. Поэтому резекция должна соблюдать определенные онкологические принципы. В зависимости от локализации раковой опухоли эти резекции дополняются удалением анатомических структур, по которым проходят пути распротранения раковых клеток.
Принципы операции включают широкую мобилизацию брыжейки с сохранением целостности фасции, центральное пересечение магистральных сосудов, питающих резецируемый сегмент кишки, с удалением всех коллекторов лимфооттока, тесно связанных с сосудистым комплексом.
Длина резецируемого участка кишки должна быть достаточной, операция должна включать удаление всех регионарных лимфоузлов, по которым возможно распространение раковых клеток.
Виды операций при раке толстой кишки
При раке левой трети поперечно-ободочной кишки, левого изгиба и нисходящей ободочной кишки выполняют левостороннюю гемиколэктомию — удаление трети поперечно-ободочной кишки с селезеночным изгибом, всей нисходящей ободочной кишки до начального отдела сигмовидной кишки.
Как было сказано выше, такой массивный объем резекции связан с особенностями кровоснабжения и лимфооттока. Мобилизацию кишки начинают с пересечения нижней брыжеечной артерии у места ее отхождения от аорты, что является профилактикой рецидива заболевания.
При поражении сигмовидной кишки объем вмешательства зависит от локализации злокачественного образования. При опухолях средней трети кишки выполняют ее резекцию. В зависимости от стадии и распространенности процесса возможно расширение резекции с перевязкой и пересечением нижней брыжеечной артерии. После удаления резецированного участка кишки анастомоз накладывается между нисходящей частью ободочной и ампулой прямой кишки.
При раке прямой кишки выбор метода резекции зависит от локализации раковой опухоли. При расположении опухоли в ректосигмоидном отделе или ампуле прямой кишки выполняется так называемая передняя резекция прямой кишки, которая не только позволяет радикально удалить опухоль, но и сопровождается хорошими функциональными результатами. Во время операции производится удаление верхних отделов прямой кишки и нижней части сигмовидной. Анастомоз накладывается между сигмовидной и оставшейся частью прямой кишки.
При поражении средней и нижней части прямой кишки, выполняется низкая передняя резекция. Операция включает удаление практически всей прямой кишки, ее брыжейки (мезоректума) вплоть до мышц анального сфинктера. Тотальная мезоректумэктомия в настоящее время является стандартом лечения опухолей прямой кишки, которые располагаются в ее нижнем отделе. При этом методе хирургического лечения частота возврата заболевания (рецидив) минимальна. После удаления части прямой кишки анастомоз накладывается между низведенным концом ободочной кишки и оставшейся самой нижней частью прямой кишки или анальным каналом. Эта операция считается сфинктерсохраняющей, однако, для разгрузки анастомоза и, следовательно, защиты может потребоваться формирование временной илестомы.
Виды анастомозов кишки
Способ восстановления целостности кишечной трубки после резекции зависит от анатомических условий и состояния кишки. Рассматривают три вида анастомозов.
- Анастомоз "конец в конец" (по типу восстановления труб газопровода) наиболее физиологичен и наиболее часто используется для восстановления целостности кишечной трубки.
- Анастомоз "бок в бок" накладывается в случаях несоответствия ширины просвета соединяемых концов кишки. В этой ситуации просветы кишечных трубок ушиваются наглухо, сбоку производится вскрытие просвета сближенных приводящей и отводящей петель. Накладывается боковой анастомоз.
- Анастомоз "конец в бок" накладывается в определенных условиях для обеспечения физиологичности поступления кишечного содержимого. Могут быть анастоматизированы участки тонкой кишки, например, при резекции желудка по Ру. Либо соустье накладывается между тонкой и толстой кишкой, например, при удалении правого фланга ободочной кишки (правосторонняя гемиколэктомия).
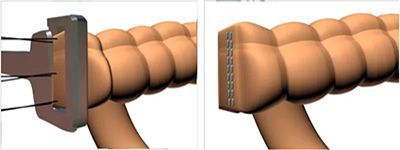
По методам выполнения выделяют ручной и аппаратный шов. Разработка и внедрение в хирургическую практику сшивающих аппаратов произвело революционный прорыв в хирургии желудочно-кишечного тракта. Аппараты обеспечивают надежное, прецизионное наложение шва. Исключается зависимость качества наложения анастомоза от квалификации хирурга. Аппаратный анастомоз надежен, прежде всего, за счет трехрядного скобочного шва, создающего герметичное сшивание тканей.
Применение сшивающих аппаратов значительно ускорило и облегчило наложение надежных анастомозов в труднодоступных, неудобных для ручного шва местах и значительно облегчило выполнение сложных операций, в частности, при низких резекциях нисходящей ободочной и прямой кишки.
Следует заметить, что компания Auto Suture™ первой в мире стала применять титановые скрепки, которые не дают артефактов при магнитно-резонансной томографии , что в последующем стало мировым стандартом для сшивающих аппаратов.
Сшивающие аппараты делятся на три группы в зависимости от функционального предназначения:
Виды хирургического доступа при резекции кишки
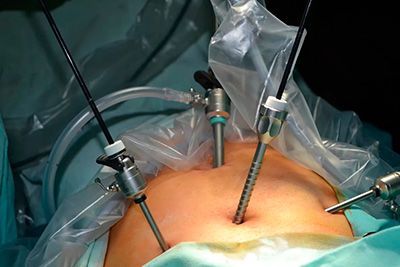
В настоящее время благодаря развитию новых технологий появились современные малоинвазивные способы хирургических вмешательств. В данном случае речь идет о лапароскопической резекции толстой кишки и прямой кишки, выполняемой через небольшие разрезы.
Таким образом, сегодня резекцию толстой кишки выполняют двумя способами: через лапаротомию и лапароскопически. Понятно, что операции через широкий разрез брюшной стенки более травматичны, хотя обеспечивают достаточный обзор и доступ к очагу поражения.
Лапароскопические операции значительно менее травматичны, однако требуют очень дорогого инструментария и оборудования. Кроме того, такие операции весьма специфичны и могут выполняться только обученными специалистами высокой квалификации.
Резекции правых отделов ободочной кишки начинают с пересечения заинтересованных сосудов. После выделения кишки (этап мобилизации) пораженная пется выводится через небольшой разрез передней брюшной стенки. Производится резекция и наложение анастомоза вне брюшной полости (экстракорпорально).
Накопленный опыт сегодня убедительно доказывает, что результаты лапароскопической резекции ничем не отличаются результатов резекций, выполненных открытым доступом. И даже напртив, оставляют за лапароскопической методикой несомненные преимущества:
- малотравматичность;
- низкий болевой синдром;
- раннюю активизацию, быструю реабилитацию больных;
- отсутствие осложнений, связанных с наличием лапаротомной раны (нагноение, образование послеоперационных грыж);
- низкий процент других осложнений, как в раннем, так и в отдаленном периоде.
В многопрофильной клинике ЦЭЛТ накоплен многолетний опыт лапароскопических резекций. Хирургическое отделение оснащено современным лапароскопическим высокотехнологичным оборудованием и инструментарием. Клиника лицензирована на выполнение онкологических операций.
В практическом отношении отработаны основные технические приемы, этапы операций на всех отделах ободочной и прямой кишки. Достигнуты хорошие результаты как в раннем, так и в отдаленном послеоперационном периоде. Проводится постоянный анализ результатов лечения, оперированные больные находятся под постоянным медицинским контролем. Мониторинг позволяет нам оценивать и улучшать достигнутые результаты.
Читайте также:

