В вертикальном закрытом цилиндре находится идеальный газ
Обновлено: 30.06.2024
Запишем первый закон термодинамики для изобарного процесса:
Выразим из этого равенства изменение внутренней энергии:
Работу газа в изобарном процессе можно рассчитать по формуле:
с учетом уравнения Менделеева-Клапейрона получим:
(2).
При совершении работы давление бензола не изменяется, так как поршень в цилиндре легкоподвижный. Давление бензола все время остается равным атмосферному.
При этом
– масса бензола, превратившегося в газообразное состояние.
Количество теплоты, которое идет на превращение бензола в это состояние можно рассчитать по формуле:
Выражение для работы бензола (2) и количества теплоты (3) подставим в уравнение (1).
После сокращения на получим искомую формулу:
Подставим численные значения и проведем расчет:
2. Одно и то же постоянное количество одноатомного идеального газа расширяется из одного и того же начального состояния до одного и того же конечного объёма первый раз по изобаре 1–2, а второй по адиабате 1–3 (см. рисунок). Отношение работы газа в процессе 1–2 к работе газа в процессе 1–3 равно =к=2. Чему равно отношение х количества теплоты полученного газом от нагревателя в ходе процесса 1–2, к модулю изменения внутренней энергии газа в ходе процесса 1–3?

Для участка 1–2 применим первый закон термодинамики с учетом изобарного процесса.
Работу газа при расширении найдем как площадь прямоугольника под графиком.
Изменение внутренней энергии одноатомного идеального газа запишем в виде формулы:
Применим уравнение Менделеева-Клапейрона:
Тогда (3) примет вид:
Таким образом количество теплоты на участке 12 равно:
Для участка 1–3 применим первый закон термодинамики с учетом адиабатного процесса.
но так как запишем:
или Это выражение означает, что газ на участке 13 совершает работу за счет уменьшения своей внутренней энергии.
Учтем, что по условию =к=2, тогда:
Используя (5) и (6) получим искомую формулу:
Секрет решения. Несмотря на громоздкие расчеты и обилие разных индексов в уравнениях, задача является среднего уровня сложности. Надо знать:
- первый закон термодинамики;
- его применение к изопроцессам;
- формулы, выражающие работу газа и его внутреннюю энергию (только для одноатомного идеального газа);
- понимать, что при расширении газ совершает положительную работу, при сжатии – отрицательную работу;
- проводить рассуждения о том, откуда газ берет энергию для совершения работы (за счет своей внутренней энергии или за счет поступления энергии извне);
- указанные пункты описывать соответствующими уравнениями.
Суть любой задачи по физике – описание физических процессов математическими уравнениями, которые надо решить удобным (рациональным) способом.

3. В тепловом двигателе 1 моль одноатомного разряженного газа совершает цикл 1–2–3–4–1, показанный на графике в координатах p–T, где p – давление газа, Т – абсолютная температура. Температуры в точках 2 и 4 равны и превышают температуру в точке 1 в 2 раза. Определите КПД цикла.
КПД теплового двигателя определяется формулой:

– полезная работа, совершенная газом за цикл, Q – полученное за цикл количество теплоты. Можно графически рассчитать работу, если перерисовать данный цикл в координатах рV. Проведем анализ каждого процесса.
В координатах рV график будет иметь вид:

Работа газа за цикл будет определяться площадью прямоугольника 1-2-3-4.

Поэтому (на основании закона Шарля).
(на основании закона Гей-Люссака).
Таким образом, можно выразить полезную работу через и

Газ получает положительное количество теплоты на участках 1–2 и 2–3.
Применим к этим участкам первый закон термодинамики.
Но работа газа на этом участке равна нулю, так как процесс изохорный.
С учетом уравнения Менделеева-Клапейрона и получим:
Для участка 23 первый закон термодинамики примет вид:
Работа определяется площадью прямоугольника под участком 23.
С учетом уравнения Менделеева-Клапейрона (4) примет вид:
Таким образом, полученное количество теплоты на участке 23 равно:
Общее количество теплоты, полученное за цикл:
Полученные выражения из (1) и (6) подставим в формулу КПД.

Секрет решения. За задачи на определение КПД тепловой машины по графику надо получать максимальные 3 балла. Эти задания сопровождаются большими расчетами, поэтому на первое место надо ставить внимательность их выполнения.
Необходимо выделить следующие моменты в решении:
- определять работу графически можно только в координатах рV;
- если в условии дан график в других координатах, то его надо перечертить в рV;
- поэтапно применять первый закон термодинамики и газовые законы для всех процессов;
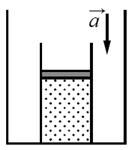
С1-1. На полу неподвижного лифта стоит теплоизолированный сосуд, открытый сверху. В сосуде под тяжёлым подвижным поршнем находится одноатомный идеальный газ. Поршень находится в равновесии. Лифт начинает равноускоренно опускаться вниз. Опираясь на законы механики и молекулярной физики, объясните, куда сдвинется поршень относительно сосуда после начала движения лифта и как при этом изменится температура газа в сосуде. Трением между поршнем и стенками сосуда, а также утечкой газа из сосуда пренебречь.
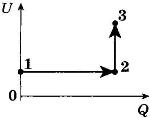
С1-2. В цилиндре, закрытом подвижным поршнем, находится идеальный газ. На рисунке показана диаграмма, иллюстрирующая изменение внутренней энергии U газа и передаваемое ему количество теплоты Q. Опишите изменение объема газа при его переходе из состояния 1 в состояние 2, а затем в состояние 3. Свой ответ обоснуйте, указав, какие физические закономерности вы использовали для объяснения.
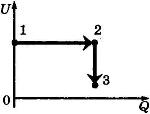
С1-2. В цилиндре, закрытом подвижным поршнем, находится идеальный газ. На рисунке показана диаграмма, иллюстрирующая изменение внутренней энергии U газа и передаваемое ему количество теплоты Q. Опишите изменение объема газа при его переходе из состояния 1 в состояние 2, а затем в состояние 3. Свой ответ обоснуйте, указав, какие физические закономерности вы использовали для объяснения.
С1-3. В цилиндре, закрытом подвижным поршнем, находится газ, который может просачиваться сквозь зазор вокруг поршня. В опыте по изотермическому сжатию газа его объем уменьшился вдвое, а давление газа упало в 3 раза. Во сколько раз изменилась внутренняя энергия газа в цилиндре? (Газ считать идеальным.)
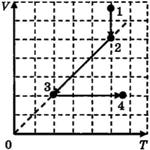
C1-5. Ha V T-диаграмме показано, как изменялись объём и температура некоторого постоянного количества разреженного газа при его переходе из начального состояния 1 в состояние 4. Как изменялось давление газа р на каждом из трёх участков 1—2, 2—3, 3—4: увеличивалось, уменьшалось или же оставалось неизменным? Ответ поясните, указав, какие физические явления и закономерности вы использовали для объяснения.
C1-6. В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают выдвигать из сосуда. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните, указав, какие физические закономерности вы использовали для объяснения.
С3-9. Нагреваемый при постоянном давлении идеальный одноатомный газ совершил работу 400 Дж. Какое количество теплоты было передано газу?
С3-11. В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 8 раз, давление воздуха в сосуде увеличилось в 2 раза, а его абсолютная температура увеличилась в 1,5 раза. Каково изменение внутренней энергии воздуха в сосуде? (Воздух считать идеальным газом.)
С3-12. В сосуде с небольшой трещиной находится воздух. Воздух может медленно просачиваться сквозь трещину. Во время опыта объем сосуда уменьшили в 4 раза, давление воздуха в сосуде увеличилось тоже в 4 раза, а его абсолютная температура увеличилась в 1,5 раза. Каково изменение внутренней энергии воздуха в сосуде? (Воздух считать идеальным газом.)
С3-13. С разреженным азотом, который находится в сосуде под поршнем, провели два опыта. В первом опыте газу сообщили, закрепив поршень, количество теплоты Q1 = 742 Дж, в результате чего его температура изменилась на некоторую величину ΔT. Во втором опыте, предоставив азоту возможность изобарно расширяться, сообщили ему количество теплоты Q2 = 1039 Дж, в результате чего его температура изменилась также на ΔT. Каким было изменение температуры ΔT в опытах? Масса азота m = 1 кг.
С3-14. С разреженным азотом, который находится в сосуде под поршнем, провели два опыта. В первом опыте газу сообщили, закрепив поршень, количество теплоты Q1 = 742 Дж, в результате чего его температура изменилась на 1 К. Во втором опыте, предоставив азоту возможность изобарно расширяться, сообщили ему количество теплоты Q2 = 1039 Дж, в результате чего его температура изменилась также на 1 К. Определите массу азота в опытах.
С3-15. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление p = 4 • 10 5 Па. Расстояние от дна сосуда до поршня L = 30 см. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газа поршень сдвинулся на расстояние х = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтр = 3•10 3 H. Какое количество теплоты получил газ в этом процессе? Считать, что сосуд находится в вакууме.
С3-16. В горизонтальном цилиндрическом сосуде, закрытом подвижным поршнем, находится одноатомный идеальный газ. Давление окружающего воздуха р = 10 5 Па. Трение между поршнем и стенками сосуда пренебрежимо мало. В процессе медленного охлаждения от газа отведено количество теплоты │Q│ = 75 Дж. При этом поршень передвинулся на расстояние х = 10 см. Чему равна площадь поперечного сечения поршня? Количество вещества газа постоянно.
С3-17. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Первоначальное давление газа р1 = 4 · 10 5 Па. Расстояние от дна сосуда до поршня равно L. Площадь поперечного сечения поршня S = 25 см 2 . В результате медленного нагревания газ получил количество теплоты Q = 1,65 кДж, а поршень сдвинулся на расстояние х = 10 см. При движении поршня на него со стороны стенок сосуда действует сила трения величиной Fтp = 3 · 10 3 Н. Найдите L. Считать, что сосуд находится в вакууме.
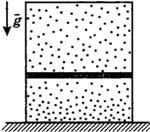
С3-18.Вертикальный замкнутый цилиндрический сосуд высотой 50 см разделен подвижным поршнем весом 110 Н на две части, в каждой из которых содержится одинаковое количество идеального газа при температуре 361 К. Сколько молей газа находится в каждой части цилиндра, если поршень находится на высоте 20 см от дна сосуда? Толщиной поршня пренебречь.

С3-19.В вертикальном теплоизолированном цилиндрическом сосуде под поршнем находится 0,5 моль гелия, нагретого до некоторой температуры. Поршень сначала удерживают, затем отпускают, и он начинает подниматься. Масса поршня 1 кг. Какую скорость приобретет поршень к моменту, когда поршень поднимется на 4 см, а гелий охладится на 20 К? Трением и теплообменом с поршнем пренебречь.
С3-20. Теплоизолированный сосуд объемом V = 2 м 3 разделен теплоизолирующей перегородкой на две равные части. В одной части сосуда находится 2 моль Не, а в другой — такое же количество моль А r . Температура гелия Т1 = 300 К, а температура аргона Т2 = 600 К. Определите парциальное давление аргона в сосуде после удаления перегородки.
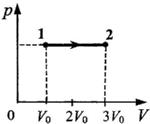
Термодинамика С3-21. На рисунке изображено изменение состояния 1 моль идеального одноатомного газа. Начальная температура газа 27° С. Какое количество теплоты сообщено газу в этом процессе?
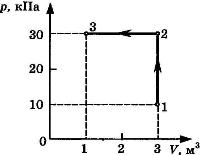
С3-23. На диаграмме представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
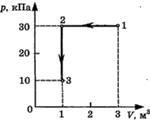
С3-24. На диаграмме представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
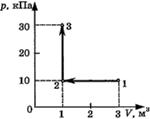
С3-25. На диаграмме (см. рисунок) представлены изменения давления и объема идеального одноатомного газа. Какое количество теплоты было получено или отдано газом при переходе из состояния 1 в состояние 3?
Задание 28. В вертикальном цилиндре с гладкими стенками под массивным металлическим поршнем находится идеальный газ. В первоначальном состоянии 1 поршень опирается на жёсткие выступы на внутренней стороне стенок цилиндра (рис. 1), а газ занимает объём V0 и находится под давлением р0, равным внешнему атмосферному. Его температура в этом состоянии равна Т0. Газ медленно нагревают, и он переходит из состояния 1 в состояние 2, в котором давление газа равно 2р0, а его объём равен 2V0 (рис. 2). Количество вещества газа при этом не меняется. Постройте график зависимости объёма газа от его температуры при переходе из состояния 1 в состояние 2. Ответ поясните, указав, какие явления и закономерности Вы использовали для объяснения.


1. Уравнение Клайперона-Менделеева для состояний газа в 1 и 2 будут иметь вид:
2. Рассмотрим силы, приложенные к поршню, когда он уже не опирается на выступы на стенках цилиндра (см. рисунок ниже).

Очевидно, что сила тяжести, равная и сила, действующая со стороны атмосферы , постоянны и направлены вниз. Учитывая, что поршень перемещается медленно, силу давления на поршень будем считать постоянной и равной , где - площадь горизонтального сечения поршня. Так как площадь постоянна, то и также постоянно. При получаем изобарный процесс при . Температура начала этого процесса найдем из системы уравнений
3. На отрезке температур процесс нагревания газа изохорный (), давление газа с ростом его температуры при нагревании увеличивается от до .
Ответ: а) при ; б) при объем газа меняется от до по закону .
График, изображающий зависимости из п. а) и б), представляет собой ломаную линию
В этой статье предложено решение задач из книги “Физика. ЕГЭ. 1000 задач”. Их очень хорошо использовать для подготовки к решению задач из блока С: во-первых, они достаточно несложные, во-вторых, в них часто нужно применять знания из динамики и статики, что позволяет закрепить их и вспомнить еще раз формулы.
![]()
м , расстояние АВ равно 0,1 м. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите длину стержня, если его считать невесомым.
Запишем уравнение моментов для рычага :
![]()
Осталось определить давление и подставить его в эту формулу.
Сначала состояние газа описывается уравнением:
Затем, прямо перед моментом открытия клапана, давление больше:
![]()
![]()
, а .
![]()
![]()
Задача 2. В вертикальном цилиндрическом сосуде с площадью поперечного сечения см ‚ ограниченном сверху подвижным поршнем массой кг, находится воздух при комнатной температуре. Первоначально поршень находился на высоте см от дна сосуда. На какой высоте от дна сосуда окажется поршень, если на него положить груз массой кг? Воздух считать идеальным газом, а его температуру – неизменной. Атмосферное давление принять равным Па. Трение между стенками сосуда и поршнем не учитывать.
Так как температура постоянна, то работает закон Бойля-Мариотта:
Запишем давления до того, как положили дополнительный груз, и после:
![]()
![]()
Тогда, подставляя давления, получаем:
![]()
Откуда, упрощая, имеем:
![]()
![]()
Ответ: см
![]()
. Обе части сосуда заполнены одинаковым одноатомным идеальным газом. Давление в первой из них равно , во второй – . Каким станет давление в сосуде, если перегородку убрать?
Состояния газа в обеих частях можно записать уравнениями:
Тогда, так как газы теплом с внешней средой не обмениваются, и работы не совершают, то их внутренняя энергия (сумма) сохраняется:
![]()
![]()
Уравнение Менделеева-Клапейрона для общего количества газа в сосуде:
![]()
И подставим в (1)
![]()
![]()
Откуда делаем вывод, что .
Ответ: .
Задача 4. Теплоизолированный горизонтальный сосуд разделен пористой перегородкой на две равные части. В начальный момент в левой части сосуда находится моль гелия, а в правой – такое же количество моль аргона. Атомы гелия могут проникать через перегородку, а для атомов аргона перегородка непроницаема. Температура гелия равна температуре аргона: К. Определите отношение внутренних энергий газов по разные стороны перегородки после установления термодинамического равновесия.
Будем решать задачу в предположении, что газы идеальны.
Аргон никуда из своей части сосуда не денется, и для него справедливо:
![]()
![]()
А гелий займет весь объем сосуда, просочившись через перегородку. Тогда
![]()
![]()
Тогда в левой части сосуда давление
![]()
![]()
.
Внутренняя энергия определяется формулой:
![]()
Тогда отношение внутренних энергий газов по разные стороны перегородки равно
![]()
![]()
.
Читайте также:

